
- 商品情報 Fluorospot キット
- 関連情報 ELISpotキット
- スライド資料 FluoroSpot [PDF:1453KB]
FluoroSpotアッセイは、単一細胞レベルで2種類のサイトカイン分泌を同時に測定することを目的としており、異なるサイトカインに特異的なモノクローナル抗体の混合物を用いてサンドイッチ法を行います。ELISpot法とは異なり、FluoroSpotアッセイではフルオロフォア標識検出試薬を用いることで、いくつかのサイトカイン(もしくはその他の分泌対象物)を同じウェル中で分析することができます。
ELISpotアッセイは、感染症、癌、アレルギー、自己免疫疾患などにおいて、特定の免疫反応を研究するのに有用であることがわかっています。その簡単さと高感度から、新しいワクチンの開発やワクチン試験のモニタリングにおいて、スタンダードツールとなっています。しかしながら、その酵素/基質ベースの検出方法のため、各ウェル中で分析できるサイトカイン/分析対象の数については制限があります。通常は1つのウェルにつき分析できるのは1つのパラメーターのみで、T細胞応答の免疫対応物として選択されているのは、IFN-γです。
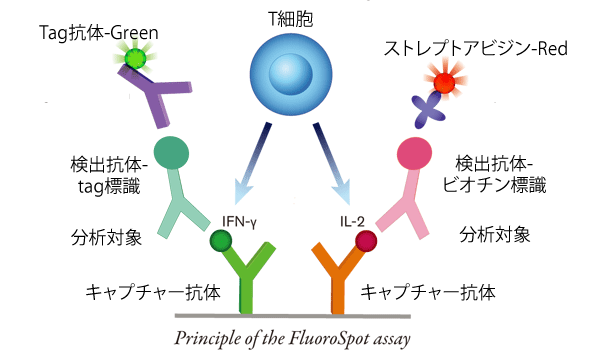
方法に多様性を持たせるため、また抗原特異的な多機能のT細胞の最近の関心に対応するため、Mabtech社ではFluoroSpotアッセイを開発し、同一のウェル中で2種類のサイトカインのうち、1つ又は両方を分泌している細胞を識別することを可能にしました。FluoroSpotアッセイは、一方の分析対象にビオチン標識検出抗体を、もう一方の分析対象にはtag標識検出抗体を用いることで、ELISpotと同様に高感度で簡単に操作できます(図1)。検出操作として、赤いフルオロフォアを結合したストレプトアビジンと、緑の蛍光で標識したTag抗体を添加することにより、シグナルを増幅します。2種類のフルオロフォアを別々に画像化できる自動蛍光リーダーによって、スポットを分析します。単色画像を重ね合わせて位置を合わせることで、2色とも発色している細胞(2種類のサイトカインの両方を分泌している細胞)を識別することができます(図2)。このプロセスにより、現在では同一ウェル中で2種類の分析対象を同時に測定することができますが、いずれ3種類以上の分析対象の同時検出に拡大することも可能です。しかし、3色のFluoroSpotについては、市販試薬として利用できるようにまでには更なる改良が必要です。
FluoroSpotアッセイは、大きなスケールのスクリーニングだけでなく、個別のテストにも適用できます。最新の手法では、ELISpotよりも優れた利点があり、単一細胞レベルでの2種類のタンパク質分泌をモニターする、全てのシステムに適応することができます。同一ウェル中で2種類の対象を分析できることで、T細胞群のより詳細な特徴を調査することができ、供給できる細胞量が制限されている場合に特に有用です。フローサイトメトリーに比べて高感度であり、細胞母集団の中で分析対象を産生している細胞が少ない状況での分析に最適です。
T細胞
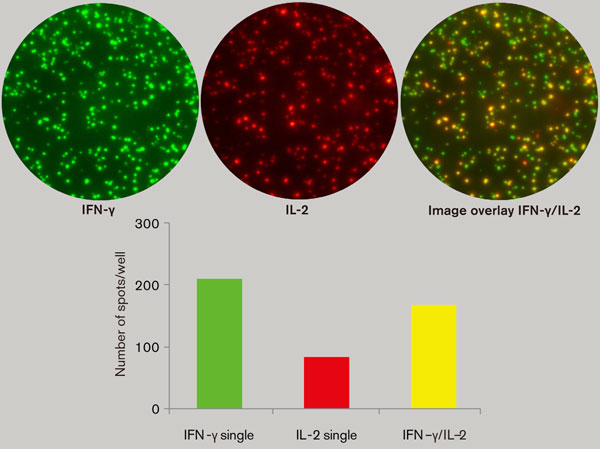
ワクチン開発研究の多くで関心を持たれているのは、抗原特異的な多機能T細胞の識別です。いくつかの研究で、IFN-γとIL-2の両方を発現している細胞は特に(その他TNF-αやMIP-1βなどが含まれる場合もある)、サイトカインを1種類しか発現していない細胞よりも、保護免疫に密接に関係していることが示唆されています。図2は、CMV、EBV、Flu由来のMHCクラス1制限ペプチドに応答して、IFN-γ及び/又はIL-2を分泌する細胞のFluoroSpotアッセイ結果を示します。CD8+ T細胞が仲介する反応は、IFN-γ分泌細胞によって制御されますが、この細胞の一部はIL-2も分泌しています。また、IL-2を分泌している細胞の大多数はIFN-γも分泌しています。
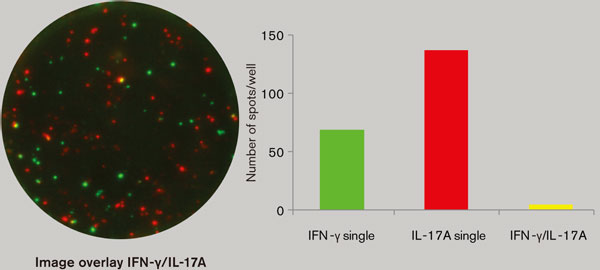
機能的なT細胞サブセットを調査するためのFluoroSpot法利用の一例として、1種類もしくは2種類のサイトカインのプロファイルを用いることにより、ヒトの結核感染の臨床ステージを識別する研究が最近発表されました。その他の例として、ヘルパーT細胞1(Th1)とTh2の比較や、Th1とTh17の比較などが行われています(図3)。
その他の免疫細胞
FluoroSpotは、T細胞に加えて、樹状細胞、単球、B細胞などのほかの細胞の分析にも利用できます。図4は、単球から分泌されるサイトカインの分析結果を示します。各細胞のサイトカインプロファイルに基づいて個々のサブポピュレーションを区別することができます。
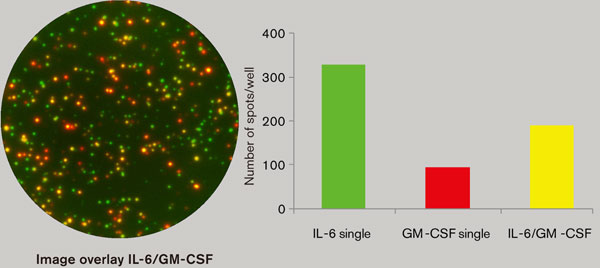
顆粒球マクロファージコロニー刺激因子(GM-CSF)及びIL-6の分泌を誘導するため、リポテイコ酸(LTA)を使用した。細胞(4,000cell/cells/well)をLTA存在下で20時間インキュベートした。重ね合わせ画像から、両方を分泌する黄色のスポットが認められた(分泌細胞の約30%)。LTA未添加のコントロールでは、5スポット未満であった。
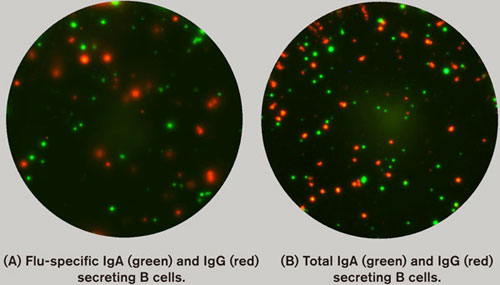
B細胞のFluoroSpotでは、抗体を分泌しているトータルの細胞数と特定の抗原に対する抗体を分泌している細胞数の両方を識別して計数することができます。フルオロフォアベースの検出により、同一ウェル中で分泌されているイムノグロブリンのアイソタイプやサブファミリーを分析することが可能で、細胞材料を節約できます。B細胞の分析における主なアプリケーション領域は、各種疾患やワクチン接種時の応答についてです。
ブタインフルエンザ(H1N1)のワクチン誘導応答についての例を図5に示します。パンデムリックス(グラクソスミスクライン社)ワクチン接種前後のIgA及びIgG分泌細胞数を調査しました。
FluoroSpotアッセイプロトコールのうち、いくつかの過程はスポットの最適な検出に特に重要です。高度に特異的なモノクローナル抗体を選択することが、最適化のための基礎となります。キャプチャー抗体を効率的に結合させるため、Mabtech社では、エタノールで簡単に前処理できる低蛍光のPVDFメンブレンのプレートをお奨めしています(図6)。キャプチャーモノクローナル抗体の密度の高さは重要で、スポットの品質と数の両方を増強します。これは、少量のサイトカインを分泌している細胞群をモニタリングする際に非常に重要です。最後に添加する蛍光エンハンサー溶液は、スポットの蛍光シグナルを更に増加させます。
プレートの分析
FITC及びCy3フィルターの自動リーダーの使用をお奨めします。分析前にプレートを完全に乾燥させてください。乾燥したプレートの蛍光は安定です(プレートは1ヶ月間保存可能です)が、PVDFメンブレンが時間と共に光を発することがあるため、1週間以内に分析することを推奨します。
重要性は低いですが、二重染色スポットを見誤る場合があります。例えば隣接する2つの細胞が、分析対象の2種類のサイトカインのどちらかを分泌していた場合、誤って二重染色としてカウントしてしまうことがあります。このようなスポットの数は、ウェル中のそれぞれのサイトカインのスポットの数と、リーダーのカウント設定(例えば、スポットセンターの間の最大距離)に依存します。得られた実験結果のうち、二重染色の認識ミスの頻度を実質的に見積もる1つの方法は、別のウェルの緑と赤の画像を重ね合わせて分析することです。そのようなマッチしない重ね合わせ画像の全ての二重染色スポットは、偽陽性スポットを示します。
CD28の刺激
抗原特異的なT細胞の刺激が、T細胞レセプター及びその同属の抗原との相互作用に依存している一方で、抗原提示細胞からの共刺激や、周囲のサイトカイン環境もまた必要です。これらのシグナルは、in vitroの細胞培養条件では、常に最適化されてはおらず、最適ではないレスポンスを引き起こすことがあります。また更に、FluoroSpot分析においては、サイトカインがキャプチャーする可能性がある生物学的影響を考慮する必要があります。
IL-2はT細胞の活性化に重要ですが、ウェル中にIL-2キャプチャー抗体が存在することから、培地中のフリーのIL-2の有効性が減少することになり、その結果、IFN-γ、IL-2を分泌するT細胞の活性化を減少させる結果になります。このin vitroでの最適でない条件を補正し、IL-2キャプチャー抗体の減少効果を回避するため、CD28モノクローナル抗体を培地に添加することができます。適切な濃度でCD28抗体を添加することで、特定の刺激のない状態でのサイトカインの分泌を増加させることなく、刺激に特異的なIL-2の分泌を高め、サイトカインキャプチャーの影響を補正することができます。あるいは、細胞をプレートに添加する前に(約6時間)プレ活性化させることもでき、この場合のキャプチャー抗体の影響は無視できる程度になります。その他のサイトカインキャプチャー抗体も影響を与えることがありますが、多くの系でCD28による刺激が有用です。
FluoroSpotにおけるポジティブコントロール
FluoroSpotにおいて、比較対照は非常に重要です。ポリクローナルT細胞活性化剤(例えばCD3抗体など)は、細胞活性及び細胞機能の両方のポジティブコントロールとして使用できる可能性があります。T細胞のサイトカインの多くは、この刺激により誘導されるため、このコントロールは様々なFluoroSpotアッセイで使用されています。その他に一般的に用いられているポジティブコントロールに、植物性血球凝集素(PHA)及びコンカナバリンA(ConA)があります。これらは両方ともT細胞の強力な活性剤であり、CD3抗体と同様にCD4+、CD8+T細胞を活性化します。
より特異的なポジティブコントロールとして、先に述べたCEF peptide poolがあります。これは、多くの人が持つT細胞に特異的な抗原に基づいています。ウイルスに特異的なCD8+T細胞によるIFN-γの産生を効果的に誘導します(白色人種では90%)。CEF peptide poolは、ポジティブコントロールとしてだけではなく、実験過程の標準化にも有用です。
Mabtech社は、ELISpotのプロトコールを最適化するために、20年以上にわたって広範囲に検討を重ねてきました。この経験に基づき、最適なキャプチャー/検出抗体ペア、フルオロフォア、試薬濃度、プレート処理法の選択等を決定することにより、FluoroSpotのプロトコールを最適化することに成功しました。Mabtech社は、最も正確なパフォーマンスを持つ分析システムを、確実にお客様にお届けすることを目標としています。FluoroSpotアッセイについて、ご質問やアプリケーション・最適化方法などのご検討をご希望の場合は、コスモバイオまでお問い合わせください。
1. De Rosa SC, et al. Vaccination in humans generates broad T cell cytokine responses. J. Immunol. 173:5372, 2004.
2. Harari A, et al. Skewed representation of functionally distinct populations of virus-specific CD4 T cells in HIV-1-infected subjects with progressive disease: changes after antiretroviral theraphy. Blood 103:966, 2004.
3. Betts MR, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells. Blood 107:4781, 2006.
4. Duvall MG, et al. Polyfunctional T cell responses are a hallmark of HIV-2 infection. Eur. J. Immunol. 38: 350, 2008.
5. Ferre AL, et al. Mucosal immune responses to HIV-1 in elite controllers: A potential correlate of immune control. Blood 113:3978, 2008.
6. Sun Y, et al. Magnitude and Quality of Vaccine-Elicited T-Cell Responses in the Control of Immunodeficiency Virus Replication in Rhesus Monkeys. J. Virol. 82:8812, 2008.
7. Day CL, et al. Detection of polyfunctional Mycobacterium tuberculosis-specific T cells and association with viral load in HIV-1-infected persons. J. Infect. Dis. 197:990, 2008.
8. Darrah PA, et al. Multifunctional TH1 cells define a correlate of vaccine-mediated protection against Leishmania major. Nat. Med. 7:843, 2007.
9. Ahlborg N, et al. Dual- and triple-color fluorospot. Methods Mol. Biol. 792:77, 2012
10. Hallengärd D, et al. Comparison of plasmid vaccine immunization schedules using intradermal in vivo electroporation. Clin. Vaccine Immunol. 18:1577, 2011.
11. Gazagne A, et al. A Fluorospot assay to detect single T lymphocytes simultaneously producing multiple cytokines. J. Immunol. Methods 283: 91, 2003.
12. Casey R, et al. Enumeration of functional T-cell subsets by Fluorescence-Immunospot defines signatures of pathogen burden in tuberculosis. PLoS One 5 (12): e15619, 2010.
13. Rebhahn JA, et al. Automated analysis of two- and three-color fluorescent Elispot (Fluorospot) assays for cytokine secretion. Comput. Methods Programs Biomed. 92:54, 2008.
14. Currier JR, et al. A panel of MHC class I restricted viral peptides for use as a quality control for vaccine trial ELISPOT assays. J. Immunol. Methods 260:157, 2002.
15. Smedman C, et al. FluoroSpot analysis of TLR-activated monocytes reveals several distinct cytokine-secreting subpopulations. Scand. J. Immunol. 75:249, 2012.
16. Kesa G. Comparison of ELISpot and FluoroSpot in the analysis of swine flu-specific IgG and IgA secretion by in vivo activated human B cells. Cells 1:27, 2012.
17. Quast S, et al. IL-2 absorption affect IFN-γ and IL-5, but not IL-4 producing memory T cells in double color cytokine ELISPOT assays. Cell. Immunol. 237:28, 2005.
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。
© COSMO BIO