近年、転写誘導の際に、ヒストン修飾によるクロマチン構造変換が重要な働きをすることが知られています(図1a)。DNA結合性転写活 性化因子が標的遺伝子に結合すると、転写共役因子がリクルートされます。転写共役因子はヒストン・アセチル基転移酵素活性を持っており、周辺のヒストンを アセチル化します。これが引き金となりクロマチン・リモデリング因子がリクルートされ、クロマチンのリモデリングが誘導され、基本転写因子とRNAポリメ ラーゼによる転写が開始します。ヒストンはアセチル化以外にもメチル化やリン酸化などの修飾を受け、転写の制御・サイレンシング・クロマチン凝縮などを引 き起こすことが知られています(ヒストン暗号仮説;図1b)。
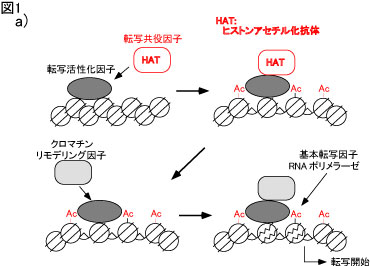
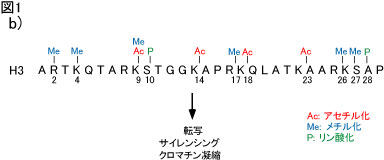
図1.ヒストンの修飾とその機能
a) ヒストン修飾とクロマチン構造変換による転写制御
DNA結合性転写活性化因子が標的遺伝子に結合すると、転写共役因子がリクルートされます。転写共役因子はヒストン・アセチル基転移酵素活性を持ってお り、周辺のヒストンをアセチル化します。これが引き金となりクロマチン・リモデリング因子がリクルートされ、クロマチンのリモデリングが誘導され、基本転 写因子とRNAポリメラーゼによる転写が開始します。
b) ヒストンH3のN末端の修飾。
ヒストンのN末端のさまざまなアミノ酸残基はアセチル化・メチル化・リン酸化の修飾を受けます。ここではヒストンH3を例として挙げました。それぞれの修 飾は別個の分子により認識され、転写の制御・サイレンシング・クロマチン凝縮などを引き起こします。
クロマチン免疫沈降法は、この様な研究の流れを受けて、個々のタンパク質と特定のゲノム領域との結合を検出するために開発されました(図2)。この方法で は、まず、生きた細胞をformaldehydeで処理することにより、クロマチン近傍に存在するタンパク質とDNAの間ならびにタンパク質相互間をクロ スリンクします。その後、細胞を溶解し、クロスリンクされたクロマチンを超音波処理により約500 bpのDNAサイズに裁断します。このようにして調整した可溶性クロマチンを、修飾(アセチル化、メチル化、リン酸化など)されたヒストン・転写因子・エ ピトープ(タグ付きタンパク質の場合)などに対する抗体で免疫沈降します。免疫沈降されたクロマチン分画を加熱処理しクロスリンクを外した後、DNAを精 製します。このDNA分画の中に、自分が調べているDNA領域がどれだけ濃縮されているかをPCR法にて定量します。
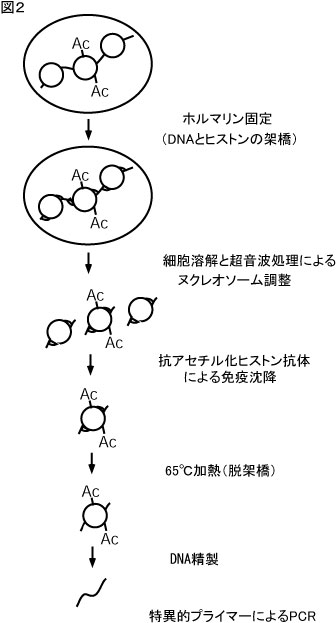
図2.クロマチン免疫沈降法の原理
この技術情報は、生田 宏一先生1)、縣 保年先生2)よりご提供いただきました。
1) 京都大学ウイルス研究所 生体応答学研究部門 生体防御研究分野
2) 京都大学大学院医学研究科 先端領域融合医学研究機構