【商品情報】 乳酸菌細胞壁溶解酵素 Labiase
技術情報
OZK社 Labiase技術情報
2. LabiaseのDNase活性に関する資料
Labiaseの DNase 活性チェックについて
以前行ったLabiaseに関するアンケートにおいてその用途についてたずねたところ、乳酸菌のゲノム、プラスミドDNAの調製に使うという意見が圧倒的に多かった。そこでLabaseのDNA分解活性について検討することにした。
【方法】
1.McIlvain buffer(pH4.0)を用いて、0.5%Labiase溶液を調製する。
2.0.5%Labiase溶液50μlに基質となるDNAを1μg添加する。
3.反応液を5本用意し、そのうちの2本は30℃で1hr加温し、別の2本は4hr加温する。また残りの1本は、0timeのBlankとして全く加温しない。
4.上記の5サンプルについてPhe/Cl処理を2回、EtOH沈殿−洗浄操作を1回行う。
5.Dry up後、45μlのTEに溶解し、5μlの10X Loading bufferを添加して、0.8%アガロースゲル電気泳動を行う。

なお、検討はLot no. JJAD1とLot no. AAAC2について行った。
【結果】
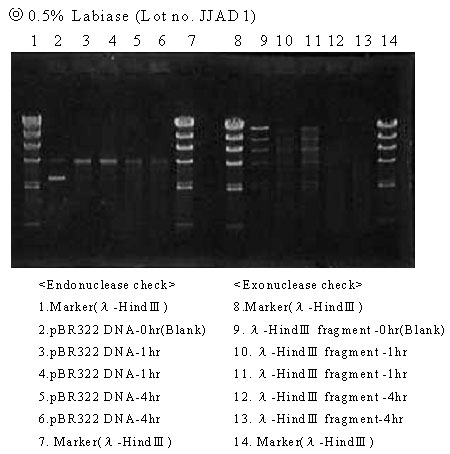 |
(判定) |
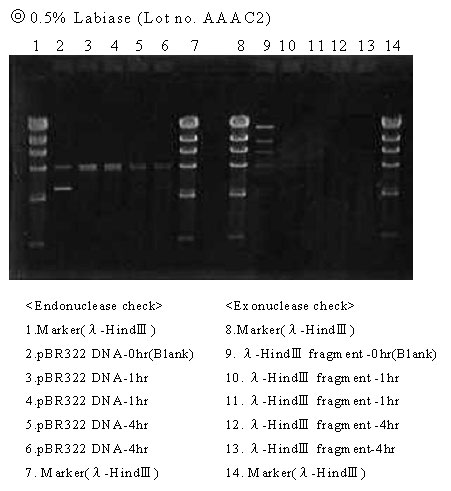 |
(判定) |
Labiaseに含まれるDNase活性の阻害方法について
前述の試験結果よりLabiaseにはDNA分解活性が存在しており、Labiaseを用いて乳酸菌からゲノム、プラスミドDNAを調製する際には、その活性を阻害しておかなければならないということがわかった。そこで、DNaseを阻害する物質として一般的なEDTAを用いてLabiaseのそれが阻害できるかどうか検討を行った。
【方法】
1.McIlvain buffer(pH4.0)を用いて、0.5%Labiase溶液を調製する。
2.0.5%Labiase溶液45μlにEDTAを最終濃度5mM、25mMもしくは50mMとなるように添加する(阻害しない時は蒸留水)。その溶液に基質となるDNAを1μg添加する。
3.反応液を3本用意し、そのうちの1本は30℃で1hr加温し、別の1本は4hr加温する。また残りの1本は、0timeのBlankとして全く加温しない。
4.上記の3サンプルについてPhe/Cl処理を2回、EtOH沈殿−洗浄操作を1回行う。
5.Dry up後、45μlのTEに溶解し、5μlの10X Loading bufferを添加して、0.8%アガロースゲル電気泳動を行う。

なお、検討はLot no. AAAC2についてのみ行った。
【結果】
以下に阻害無しの場合と、5mM EDTAで阻害した場合の結果を示す。
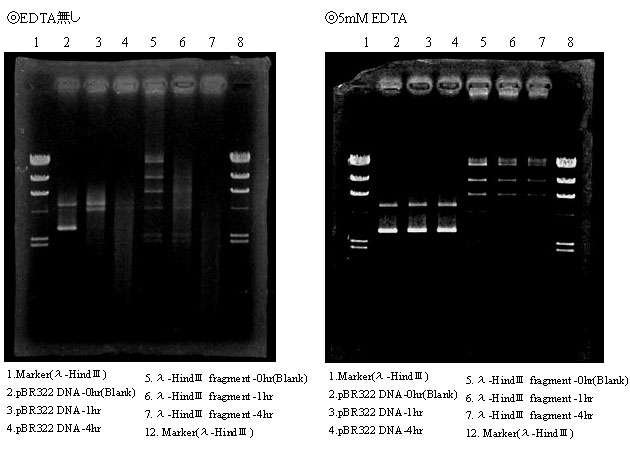
上の2枚の写真を比較すると、EDTAがない場合はやはりBlankで存在していたバンドが4hr後には完全に消失いていたが、5mM のEDTAを反応液中に存在させておくと、DNAの分解は一切見られなかった。なお、最終濃度が25mM,50mMの時も同様の結果であった。
よって上記の結果よりLabiaseに含まれる両DNase活性(Endonuclease,Exonuclease)は、反応液中に少なくとも5mM以上のEDTAが存在していれば完全に阻害されるということがわかった。
| 【結論】 LabiaseにはDNase(EndonuculeaseおよびExonuclease)活性が存在するが、通常のDNAを取り扱う際のEDTA濃度条件を満たしていれば、それらの活性は阻害され、特に操作上問題はないと結論づけられた。 |
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。

























