2.1 透過性とは何ですか?
生体透過性とは、分子が生体膜またはバリアを通過することを示します。 細胞膜は選択的透過性を持っており、物質は無差別にバリアを通過することができません。物質の極性、疎水性、電荷、大きさおよび形状は、透過性に影響を与える特性の一つであり (1)、かつ膜自体の特性も重要です。 透過性と輸送の研究には、蛍光デキストラン誘導体やさまざまなサイズのその他の多糖がたびたび使用されます。蛍光測定では、生体蛍光顕微鏡を使用してリアルタイムで定性データを得ることが可能です。
2.2.様々な種類の透過性の研究
透過性は、細胞、組織、ヒト(非臨床)および動物で研究されています。血管透過性 (2,3)、糸球体濾過 (4-6)、および血液脳関門 (7)の研究では、TdB Labs 社の蛍光誘導体が使用されています。 また、TdB Labs 社のデキストラン誘導体は、ケラチン(8)、上皮 (9-11)、粘膜層 (12,13)の透過性の研究や、内部組織 (14,15)、神経幹細胞 (16)、および腎組織 (17)の研究にも使用されています。TdB Labs 社のカルボキシメチル (CM) 基またはジエチルアミノエチル (DEAE) 基で官能化された多糖類は、透過性に対する電荷の影響を研究するために使用されています (18-20)。
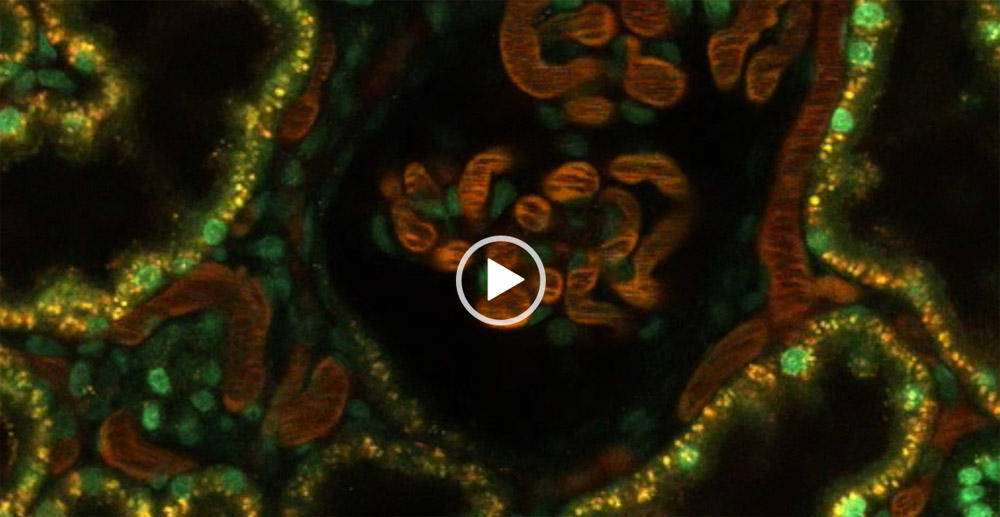
ラットの腎臓における微小血管の流れと糸球体濾過の動画
TdB Labs 社の 150 kDa TRITC-デキストラン (赤色、微小血管の流れ) と 4 kDa FITC-デキストラン (緑色、糸球体濾過) を使用した。動画の最初の部分では、中央にある糸球体と周囲の尿細管の断面図 (オレンジ色) が映っている。150 kDa の大きな TRITC-デキストランが最初にゆっくりと注入され、物質が血流全体に分布するにつれて蛍光強度がスパイクとして現れる。平衡化された後、小さな 4kDa FITC -デキストランを注入すると、糸球体濾過バリアを素早く通過し、糸球体を取り囲む近位尿細管に沿って移動する。
動画提供:TdB Labs AB 社およびRuben Sandoval 氏
- 商品情報:FITC標識デキストラン
- 商品情報:TRITC標識デキストラン
- 商品情報:Antonia Red™標識デキストラン
- 商品情報:ATTO™ 標識デキストラン