
日本薬科大学 薬学部薬学科・臨床薬剤学分野 教授
山田 泰弘 先生

日本薬科大学 薬学部薬学科・臨床薬剤学分野 教授
山田 泰弘 先生
ヒト肝細胞は、現在の創薬研究(図1)、その中でも特に薬物動態研究にとって必須の実験ツールの一つであるだけではなく、今後は再生医療や細胞移植治療を担う重要な供給源となることも期待されている。そのためには、肝機能を高発現しているヒト肝細胞を安価で安定供給することを実現するのが重要なキーポイントとなる。しかしながら、通常の培養法では肝細胞は増殖することなく、薬物代謝機能を含めた肝機能が培養期間中に急激に低下する。これらのことが原因で、肝細胞は創薬研究では限られた活用に留まり、再生医療や細胞移植治療などの医療分野では、まだ一般的な活用にまでには至っていない。さらに、倫理的観点の面から創薬研究のために日本人の肝細胞を入手することは非常に困難であり、そのほとんどが欧米からの入手に限られている。そのためにヒト肝細胞は非常に高価となり、創薬研究での使用が制限されているのが現状である。この様な問題点の克服や医療分野への積極的な活用を目指して、新規細胞培養法の工夫や増殖可能な初代ヒト肝細胞の代替肝細胞の創生が検討されている。例えば、前者の培養法工夫の場合ならば、肝細胞と肝非実質細胞との三次元共培養などにより、薬物代謝酵素を含めた肝機能が長期間の培養期間に亘って高いレベルで維持されることが報告 [1][2] されている。また、後者の増殖の問題に関しては、落谷 孝広 博士ら [3] あるいは中村 和昭 博士ら [2] が構築したヒト肝癌由来肝細胞株であるHepG2細胞をDNAメチル化阻害剤でエピゲノム処理した細胞(R-HepG2細胞)や低分子化合物による成熟肝細胞から肝前駆細胞へのリプログラミング法 [5] などが報告されており、これらの技術から創生された代替ヒト肝細胞(肝細胞様細胞)の今後の応用が期待される。ここでは、薬物動態研究においてヒト肝細胞が必要な理由とその研究を実施するために必要とされるヒト肝細胞の特性プロファイルについて簡単に紹介する。
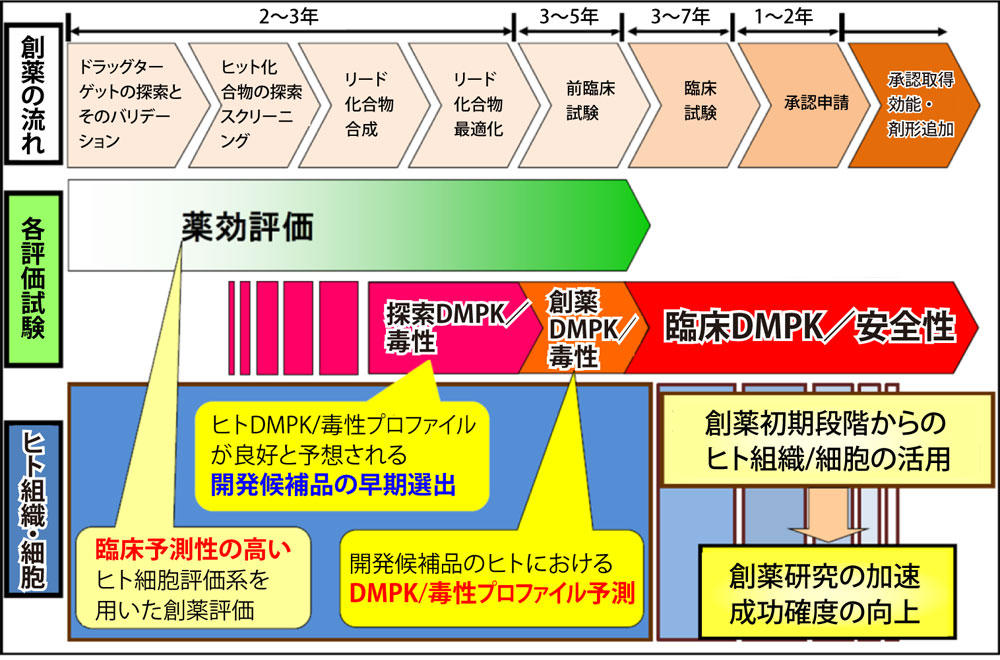
図1 創薬研究におけるヒト肝細胞のポジショニング
創薬における薬物動態研究の究極の使命は、新薬候補薬物の前臨床試験から臨床Phase Ⅰ試験への移行期において、ヒトにおける体内動態の予測(血漿中濃度推移、投与量と投与回数からの安全性マージンおよびヒト特異的代謝物の生成などの予測)および薬物間相互作用と胆汁うっ滞を含む薬剤性肝障害などの可能性予測であるが、それらの予測のほとんどは肝細胞由来試料を用いて検討されている。その理由は、投与された薬物の生体内動態は、薬物の吸収、分布、代謝および排泄の4過程によって決定されるが、これらの過程の中で最も重要なのが代謝である。この代謝の大部分は肝臓において、一部が小腸において行われているが、小腸での代謝は消化管からの吸収過程での代謝がほとんどであり、吸収後の生体内あるいは非経口投与での代謝にはほとんど関与していない。つまり、薬物体内動態における小腸での代謝への寄与は限定的であり肝臓と比べたら小さいので、薬物の生体内運命を決定する主要臓器は肝細胞であり、その中の肝細胞に発現している薬物代謝酵素とトランスポーターの機能であると言える。
新薬候補薬物のヒトにおける体内動態の予測では、実験動物を用いたアニマルスケールアップ(Allometric Scaling)法やヒトおよび実験動物の肝ミクロソームあるいは肝細胞を用いた代謝実験からのin vitro / in vivoスケーリングファクター法(図2)などが実施されている。また薬物間相互作用や薬剤性肝障害などの予測では、ヒトの肝ミクロソームあるいは肝細胞を用いたin vitro 試験が実施されている。これらの予測の中で、CYP阻害評価などの一部のin vitro試験では、肝細胞分画のミクロソーム画分を用いた評価が主に実施されているが、薬物代謝反応には酸化、還元および加水分解反応を担う第Ⅰ相代謝反応が相互に複雑に絡み合った後に、グルクロン酸抱合やグルタチオン抱合などの抱合反応を担う第Ⅱ相代謝反応がシーケンシャルに行われることによって、代謝クリアランスが決定されたり、代謝物が生成されたりするので、より確かな予測を実施することを考慮すると、肝細胞を用いた試験の実施が必要となる。なぜならば、ミクロソーム画分やサイトゾール画分などの肝細胞分画を酵素源とした場合、各画分には一部の薬物代謝酵素しか局在しておらず、全ての薬物代謝酵素が発現維持されているのは肝細胞のみだからである。また、肝細胞への薬物の取込みや胆汁排泄機能に関するトランスポーター機能の評価およびCYP誘導能評価などは、肝ミクロソーム画分などを用いた細胞分画試料で試験を実施することは不可能であり、これらの試験を実施できるのは肝細胞だけである。
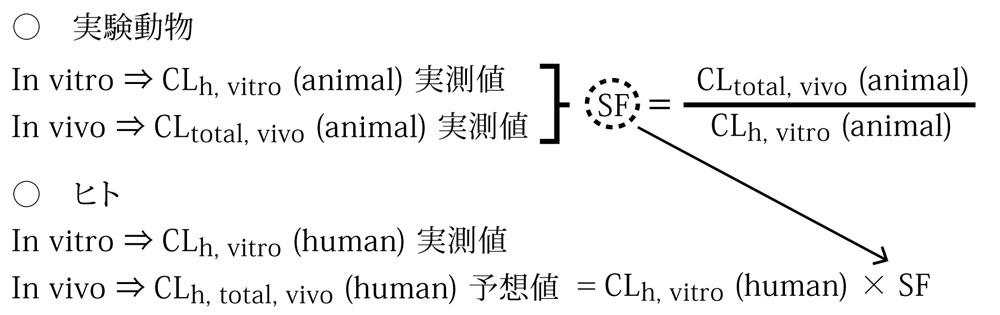
図2 in vitro / in vivo スケーリングファクター法
肝細胞に発現している主な肝機能(図3)としては、(1)薬物代謝(第Ⅰ相と第Ⅱ相反応)酵素活性、(2)トランスポーター(取込みと排出)機能、(3)胆汁分泌機能(排出トランスポーター機能を含む)(4)薬物代謝酵素やトランスポーターの誘導能、(5)胆汁産生能、(6)アンモニアなどの解毒能、(7)糖新生や脂質代謝能、および(8)アルブミンなどのタンパク質産生能などがある。これらの肝機能を高レベルで全て発現維持されているヒト肝細胞の活用が望まれるが、そのような細胞を入手して創薬研究に活用することはほぼ不可能である。しかし、必ずしも全ての肝機能が高く発現維持されていなくても、一部の機能が発現維持されているだけでも創薬研究に活用することは可能である。例えば、薬物動態研究では(1)〜(4)のいずれかの機能が維持されているだけでも十分な薬物代謝機能評価を行うことは可能である。
(1)〜(4)の機能のいずれかが発現維持されている肝細胞の薬物動態研究への活用法について、下記に概説する。
薬物の代謝クリアランスを求めたり、ヒト特有の代謝物の有無を検索したり、CYP阻害評価試験を実施したりすることが可能である。これらの試験は、肝ミクロソームを酵素源として実施することも可能であるが、上述したように薬物代謝反応は第Ⅰ相反応が相互に絡み合った後に第Ⅱ相反応がシーケンシャルに行われているので、前者2つの代謝クリアランスとヒト特有代謝物の検討においては、全ての薬物代謝酵素が発現維持されている肝細胞を用いた試験の実施が重用であり、信頼性と確実性の高い結果を得るためには肝細胞を用いた試験を実施すべきである。
薬物間相互作用の評価に繋がるトランスポーター機能の阻害試験の実施が可能であり、特に胆汁分泌に関与する排出トランスポーターの機能が維持されていれば、薬剤性肝障害の一つである胆汁うっ滞型肝毒性を評価できる可能性もある。
誘導のメカニズムは、薬物が転写因子AhR (Arylhydrocarbon Receptor)や核内オーファンレセプターであるCAR (Constitutive Active Receptor)、PXR (Pregnane X Receptor)などのレセプターと結合(あるいは活性化)した後、遺伝子上流に存在して誘導剤に応答する塩基配列XRE (Xenobiotic Response Element)に結合して、転写活性化を起こすことによってタンパク量が増加すると考えられているので、誘導能を評価できるのは肝細胞が唯一のツールである。なお、薬物代謝酵素活性が極めて低い場合でも、Basal活性値が測定可能であれば、リファンピシンやフェノバルビタールなどのポジティブコントロールとの相対比較から、誘導能評価は可能である。
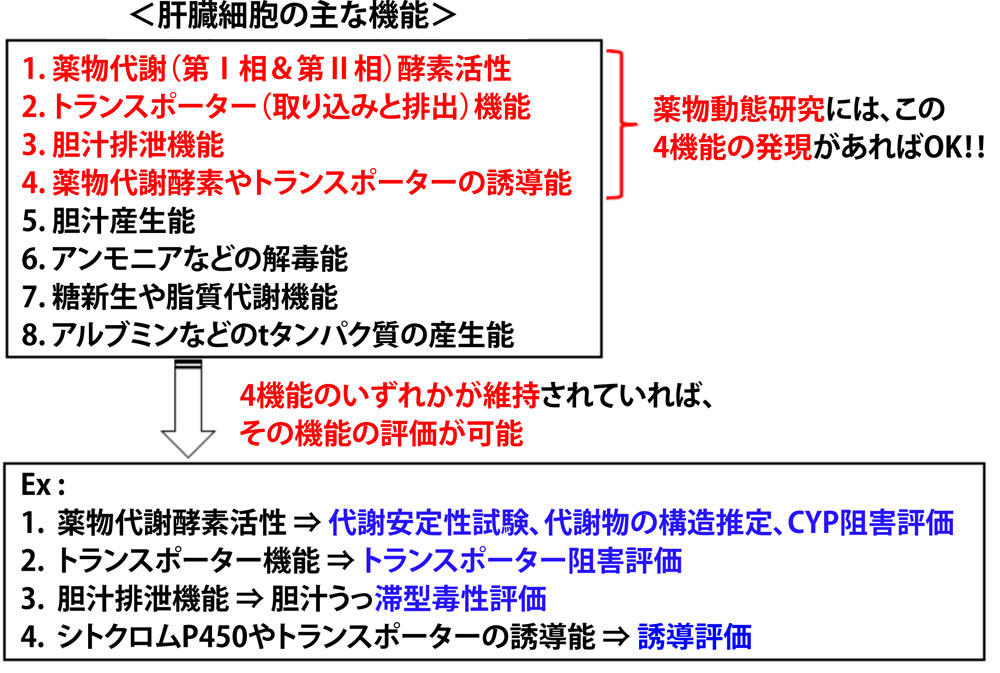
図3 薬物動態研究に必要とされる肝機能
ヒト肝細胞は、創薬研究のツールだけではなく、細胞移植治療などの医療分野でも必要とされている。しかし、現状は高いレベルの肝機能を発現維持した肝細胞を安定供給できるまでには至っていない。このような問題を克服するためには、凍結保存されているヒト肝細胞の肝機能を培養することにより向上させたり、長期間に亘って機能を維持させたりするための培養培地やデバイスの改良を含む新規培養法の更なる構築が今後も必要であると思われる。また、入手したヒト肝細胞を増殖させることもこの問題点のブレークスルーの一因になると思われるので、ヒトiPS細胞を含めた幹細胞由来分化肝細胞やiPS細胞を介さない細胞運命転換であるエピジェネティックあるいはダイレクトリプログラミング技術による代替ヒト肝細胞の創生技術の構築と活用が望まれる。その他に、創薬研究への安定供給に限定すれば、PXB-マウス(uPAトランスジェニックとSCIDの両方の形質を持つ重度免疫不全肝障害マウス)に正常ヒト肝細胞を移植したキメラマウス由来の新鮮肝細胞(PXB-cells) [6] も注目されているが、更により活用しやすくするためには、この細胞の凍結保存技術の構築が必要だと思われる。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について
© COSMO BIO