技術情報
準備
以下については、キットに含まれておりませんので、事前にご準備ください。
- 21G 針
- 1 ml シリンジ
- 1000 µL及び200 µLマイクロピペット、チップ
手順
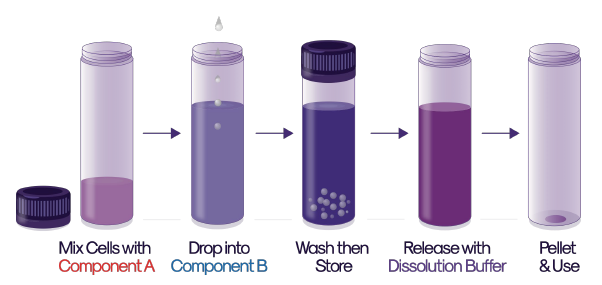
- ゲル化
- 使用前にすべてのコンポーネントが室温まで平衡化されていることを確認し、クリーンベンチ内のすべてのステップを室温で実施する。
- 1サンプルあたり0.275 mLの培地に、最終的に希望するカプセル化細胞密度の2倍の密度で細胞を再懸濁する。
※推奨されるカプセル化された細胞密度は、サンプルあたり最大1×107cellsです。 - 滅菌チューブ内の1 サンプルあたり 0.275 mL の細胞懸濁液に、Component A を 0.275 mL 添加する。
- マイクロピペットを使用して5〜10回、または細胞が十分に懸濁するまで、ゆっくりと混合する。
- 溶液を1 mLシリンジに充填する。
メモ:溶液を出す前に、分注時に溶液の容量を完全にパージできるようにエアスペースがあることを確認してください。 - 21Gの針を使用し、細胞/ゲル溶液0.5 mLを液面上約1〜2 cmの高さから、Component B にゆっくりと滴下し、ビーズを形成させる。
- Component B 中のビーズを室温で8分間安定させる。
- 1000 µLのピペットまたは注射針つきシリンジを使用して Component B を除外し、ピペットまたは注射針をチューブの内側に導いて、ゲル化したビーズが乱されないようにする。
- ビーズを1 mLの培地で2分間洗浄する。
- 5.5 mL の保存用培地に交換する前に洗浄液を除去する。
- チューブをしっかりと密封し、適切な温度(冷蔵では2〜8℃、室温管理(CRT)包装では10〜20℃の間、または温度管理された部屋)で保管する。
※Atelerix社では、特定のセルタイプに適した保存温度を推奨しています。 - リリース
- 使用前にすべてのコンポーネントが室温まで平衡化されていることを確認し、クリーンベンチ内のすべてのステップを室温で実施する。
- ビーズから培地を除去し、5 mL の Dissolution Buffer を加える。
- 穏やかに撹拌しながらビーズを最大10分間溶解させ、すべてのビーズが完全に溶解することを目視で確認する。
- 直接完全な細胞懸濁液を使用するか、350RCFで5分間遠心分離して細胞を沈降させ、上清を除去し、選択した添加剤に細胞を再懸濁する。
準備
キットの構成品は、少なくとも使用20分前に4℃保存から取り出し、室温に戻してください。
以下については、キットに含まれておりませんので、事前にご準備ください。
- 接着細胞培養用 96well plate
- 1000 µL及び 200μLマイクロピペット、チップ
- 培養培地
手順
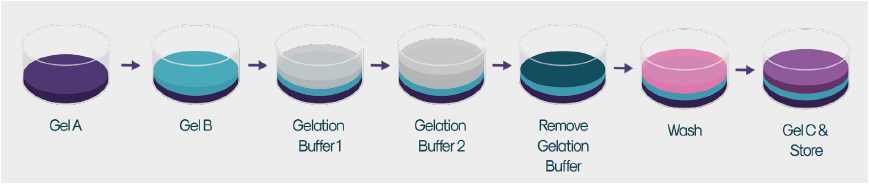
- ゲル化
- 使用前にすべてのコンポーネントが室温まで平衡化されていることを確認し、クリーンベンチ内のすべてのステップを室温で実施する。
- ゲル濃縮物を含むチューブに完全培養培地を直接添加し、ゲルA、ゲルB、および ゲルC を5倍希釈します。その後、10秒間ボルテックスして混和するまたは、ピペットで均一になるまで静かに混和する。
- 細胞培養プレートの各ウェルから慎重に培養培地を取り除く。
- 希釈したゲルA 溶液0.09 mLを各ウェルに加える。
- 希釈したゲルB 溶液0.09 mLを静かに加える。
- Gelation Buffer 1 (GB1)0.05 mL をゲル A/B 溶液の表面に滴下します。ゲル化には10分間程度かかります。
- Gelation Buffer 2 (GB2)0.05 mL をゲル A/B 溶液の表面に滴下します。ゲル化には、さらに10分間程度かかります。
- 各ウェルから GB1/GB2 混合液を除去し、1ウェルにつき 0.2 mL の培養培地で 5 分間洗浄する。
- 培養培地を除去し、ゲル化した表面の中央に0.09 mLの希釈ゲルC 溶液を追加する。
- プレートの表面にプレートシールを貼り、適切にシールされていることを確認する。
- 蓋を元に戻して、光を避けて適切な温度で保管します。出荷前に4時間静置する。
※Atelerix社では、特定のセルタイプに適した保存温度を推奨しています。 - リリース
- 使用前にすべてのコンポーネントが室温まで平衡化されていることを確認し、クリーンベンチ内のすべてのステップを室温で実施する。
- プレートシールを外し、P200 チップを使用して Dissolution Buffer 0.1 mL を注入し、5 分間脱ゲル化する。
※注)ピペットの先端でゲル表面に穴を開け、Dissolution Bufferを注入する。 - ウェルの内容物0.2 mLを除去する。
- 0.2 mLのDissolution Bufferを加え、10分間脱ゲル化する。
- 0.4 mL(各ウェルの残りの内容物)を除去する。
- 各ウェルを培養培地に置き換える。
- 4時間または一晩、通常の培養条件に戻す。
準備
キットの構成品は、少なくとも使用20分前に4℃保存から取り出し、室温に戻してください。
以下については、キットに含まれておりませんので、事前にご準備ください。
- 1000 µLマイクロピペット、チップ
- 培養培地
- 滅菌ピンセット
手順
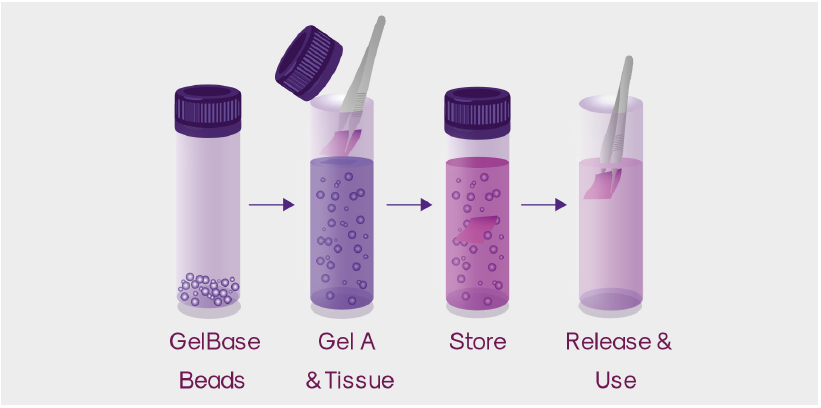
- ゲル化
- 使用前にすべてのコンポーネントが室温まで平衡化されていることを確認し、クリーンベンチ内のすべてのステップを室温で実施する。
- 培養培地をゲル濃縮液の入ったチューブに直接添加し、Gel A を5倍希釈する。その後10 秒間ボルテックスで混ぜるか、ピペットで均質になるまで静かに混ぜる。
- GelBase Beads を入れたチューブに0.6 mLの Gel A を加える。
- チューブを反転させ、GelBase Beads を Gel A 全体に分散させる。
- 滅菌ピンセットを使用して、組織を Gel/Beads 混合物にスライドさせ、組織がゲルで完全に覆われていることを確認する。 この操作は、Gel A を添加してから20分以内に行う必要があります。
※推奨される組織サイズは、サンプルあたり0.1 cm x 0.1 cm x 0.1 cm〜0.5 cm x 0.5 cm x 0.5 cmです。
※封入、保管、およびリリースには、GelBase Beads が含まれている付属のコレクションチューブを使用します。 - 蓋を元に戻し、しっかりと密閉する。(Gel A は約30分以内に硬化し、サンプルは1時間後に出荷可能になります)。
- 適切な温度で光を避けて保管する。(室温管理(CRT)包装(15〜25℃)または温度制御された環境で)。
- リリース
- チューブの蓋を外し、針つきのシリンジまたはピペットチップ付きのピペットを使用して、1 mLの Dissolution Buffer をゲルに注入し、組織を乱さないよう注意する。
- 滅菌ピンセットで組織サンプルを回収する前に、時々チューブをかき混ぜながら Gel A を10分間溶解させる。
- 培養培地または緩衝液で組織を洗浄する。
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては
使用しないように、十分ご注意ください。





























