- ホーム
- 2010:シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」
2010:シグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」
2010: Signaling Breakthroughs of the Year

Sci. Signal., 4 January 2011
Vol. 4, Issue 154, p. eg1
[DOI: 10.1126/scisignal.2001770]
Elizabeth M. Adler*
Senior Editor of Science Signaling, American Association for the Advancement of Science, 1200 New York Avenue, N.W., Washington, DC 20005, USA.
* Contact information. E-mail: eadler@aaas.org
要約:Science Signaling編集部のメンバーは、シグナル 伝達のブレイクスルーとして、「メガ」の大規模系統解析と「ミクロ」のタンパク質構造から得られた洞察を、代謝と遺伝学における新たな知見とともに推薦し た。また、がん、糖尿病、アルツハイマー病に対する新たな治療的手段につながる可能性のある調査研究も、自然免疫細胞の予想外の不均一性の同定とともに、 ブレイクスルーに選出された。
Science Signaling編集部委員一同、今年も細胞シグナル伝達研究の新年を年1回の特集であるシグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」とともに始められることを嬉しく思う。リストを編集するにあたり、われわれはScience Signaling編 集部のメンバーに、2010年のシグナル伝達研究においてもっとも心躍る進展を表した論文を推薦するよう依頼した。細胞シグナル伝達における大きな進展は いずれもリスト入りに相応しいものばかりであるが、推薦者らがとくに注目したのは、新たな研究の方向性を切り拓く可能性のある予想外の進展および進歩で あったことをここに申し添えておく。われわれは、推薦された論文のリスト(いずれも注目に値する進展を表すものばかり)を選別し、ここで紹介する最終リス トとした。最終リストに選ばれた論文には、大規模解析を用いた研究、代謝と遺伝学における新たな知見、がん、糖尿病、アルツハイマー病に関連する研究、タ ンパク質構造に基づく洞察、粘膜関連自然免疫細胞の大幅な不均一性の同定が含まれる。今年、推薦を寄せてくださったIvan Dikic(Goethe University Medical School, Germany)、Henrik Dohlman(University of North Carolina Chapel Hill, USA)、David Fruman (University of California, USA)、Tony Hunter(Salk Institute, USA)、Randall Moon(University of Washington, USA)、Michele Pagano(New York University School of Medicine, USA)、Norbert Perrimon(Harvard Medical School, USA)、Solomon Snyder(Johns Hopkins University, USA)、Eric Vivier(Centre d'Immunologie de Marseille-Luminy, France)、John Walker(University of Missouri, USA)、以上の科学者の皆様に感謝を申し上げる。
細胞シグナル伝達は、伝統的にシグナル伝達「経路」という言葉で描写され、その「経路」に沿って、細胞外または細胞内の刺激が一連の 分子イベントを起動させ、予測可能な単独応答または一連の応答を引き起こすとされてきた。もちろん、私たちの細胞ひとつひとつの内側で繰り広げられる分子 の複雑な振り付けのダンスに対する見方として、これが過度に単純化された見方であることは、研究者らも随分前から承知している。線状のシグナル伝達経路の 先にある分子の相互作用ネットワークを見ることの重要性は、昨年のシグナル伝達の「ブレイクスルー・オブ・ザ・イヤー」で1つのテーマとして浮上した。今 年もその傾向は継続され、そのようなネットワークレベルの解析を可能にする大規模なスクリーニングを含む研究に科学者6人の推薦が集まった。これらの推薦 のなかには、そのような研究から生まれる新たな洞察を重視したものもあれば、そのようなアプローチ全体としての前途の有望性を重視したものもあったが、い ずれも多数の細胞成分の同時解析に基づく研究に関するものであった。「大規模スクリーニング」を推薦するにあたって、Moonは、「シグナル伝達経路の研 究を、単一成分とその制御の観察から、タンパク質の大集団を解析する領域へと押し上げる」力があり、「これは、数十年間続いたシグナル伝達の研究手法から の明らかな脱却であり、テクノロジーとバイオインフォマティクスの発達によって、何百ものシグナル伝達成分に起きる変化を同時に特徴づけ、それらが時間と ともにどのように変化するかを解明することになるだろう。これは、シグナル伝達の予測的数学モデルを確立するための必須条件である。これによって、シグナ ル伝達の研究はシステム生物学へと転換されることになる」という理由を挙げ、その重要性を主張した。
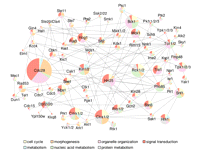
先進的な細胞シグナル伝達におけるこのような大規模解析の展望の例として、Moonは、in vivoにおけるタンパク質と疎水性低分子代謝物の間の相互作用に関するLiら(1) の研究を推薦した。この研究は、酵母キナーゼの約20%がそのような代謝物に会合することを示し、細胞成分の大多数を占める低分子代謝物がタンパク質機能 の制御においてこれまで一般に認められてきたよりも幅広い役割を果たす可能性を示唆している。Frumanは、昨年のいくつかの論文が免疫系におけるマイ クロRNAの機能についてのわれわれの理解に大いに貢献したとコメントし、Kuchenら(2) が「発生中および抗原依存性分化後の多様な免疫細胞サブセットを横断するマイクロRNA発現のカタログを作成するために、超高処理配列解読装置を用いた」 ことに注目した。HunterとWalkerの両者は、出芽酵母におけるキナーゼとホスファターゼの相互作用ネットワークを同定するために質量分光分析を 使用することで、キナーゼとホスファターゼが連係して細胞活動を調整する様子を解明し、これらのシグナル伝達タンパク質の予想外の機能を示唆する関連を見 出したBreitkreutzら(3)の論文を推薦した(図1)。 たとえば、細胞周期ホスファターゼCdc14は、主要なネットワークハブとして登場し、マイトジェン活性化プロテインキナーゼ(mitogen- activated protein kinase:MAPK)シグナル伝達、細胞代謝、DNA損傷応答(腫瘍発生に対する重要な防御として作用するほか、それ自体もいくつかの注目に値する論 文の焦点として登場した)と関連した。
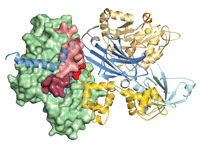
HunterとPaganoの両者は、DNA損傷応答における新たなプレーヤーを同定するために大規模スクリーニングを用いた論文を 推薦した。推薦するにあたって、Paganoは「DNA損傷に応答した細胞チェックポイントの活性化は、腫瘍の発生に対する重要な早期障壁となっている。 DNA損傷タンパク質の不活性化が増殖に対するこの障壁を除去するだけでなく、DNA損傷応答の失敗が原因で起きるその後の変異がさらなる腫瘍発生を促進 させる可能性もあり、DNA損傷応答の不活性化はヒトがんの特徴となっている。2010年、いくつかのゲノムワイドなRNAiスクリーニングとプロテオミ クススクリーニングによって(中略)DNA損傷応答とDNA修復に関与する新たな遺伝子が同定された」と説明した(4〜8)。 ファンコニ貧血(Fanconi anemia:FA)経路は、DNA複製を遮断する損傷である鎖間架橋の修復に特異的に関与する。そのため、この遺伝子障害を伴う個人はさまざまな発生異 常、がんに対する高い罹患率、一部の抗悪性腫瘍薬などの鎖間架橋試薬に対する過敏性を示す。shRNAのスクリーニングを使用し、FAN1(FANCD2 関連ヌクレアーゼ1)をFA経路の一部としてDNA損傷部位にリクルートされる修復ヌクレアーゼとして同定したSmogorzewskaら(4)の研究も、Kratzらの研究(図2)(9)とともに、Hunterの目に留まった。KratzらはFAN1をFA応答に関連付け、このヌクレアーゼを枯渇させた細胞で鎖間架橋試薬への感受性が高まることを示した。MacKayら(10)は、FAN1をFA経路と関連づける3つ目の研究を発表した。FAN1のリクルートはそのユビキチンドメインと、FANCD2(DNA修復を調整するFANCI-FANCD2複合体の構成要素)のユビキチン化に依存する。
図2.
シスプラチンは、C. elegans(線虫)の生殖細胞においてDNA損傷部位へのFAN1のリクルートを促進する。
[CREDIT: REPRODUCED FROM (9) WITH PERMISSION OF ELSEVIER]
Dikicは、基本的なオートファジー条件下にあるヒト細胞においてユビキチン化が重要な役割を果たすもうひとつの細胞過程であるオートファジーのネットワーク概観を提供したBehrendsらの論文(11) を推薦し、「これは、409の相互作用タンパク質間にある751の相互作用で構成されるネットワークを含む最初のスナップショットである。さまざまな細胞 条件下にあるオートファジーネットワークのダイナミックな変化をモニタリングするうえで、将来の挑戦のためのスタート地点となるだろう」と述べた。また、 ユビキチン鎖の連結に特異的な抗体の開発と、ユビキチンシグナル伝達経路のダイナミクスの精査におけるそれらの貴重な役割(12) にも注目した。この翻訳後修飾に関連する最終研究で、Hunterは、メラノーマ抗原(melanoma antigen:MAGE)タンパク質(その多くはさまざまながんで異常発現され、機能不明のまま癌免疫療法の標的としての役割を果たしてきた)が RINGドメイン型ユビキチンリガーゼサブセットと結合してその活性を亢進する機能をもつことを確認したDoyleら(13)の論文を推薦した。
MAGEタンパク質は、単に悪性細胞における異常発現によってがん療法の標的を提供しているが、その一方で、細胞機能(とそれがどの ように機能しなくなるのか)についてのさらなる理解が闘病のための改善された新手法につながりうるということも、細胞シグナル伝達研究の希望と展望のひと つになっている。細胞代謝(細胞がエネルギーを得るために栄養素を分解し、エネルギーを利用してより単純な成分から高分子を合成する一連の酵素反応)はす でに徹底的に研究されているため、この細胞生物学の基礎領域にまだ明かされていない新たな秘密が残されているとなれば、それは驚きをもって迎えられること だろう。次の3つの推薦がまさにそのもので、がん細胞における代謝異常についてのわれわれの理解のブレイクスルーに影響する。がん細胞では、非悪性細胞と は異なり、乳酸産生の増大を伴う好気性解糖系が示されることが観察された(ワールブルク効果)のは、前世紀前半のことである。この代謝シフトには、解糖系 酵素であるピルビン酸キナーゼのM2アイソフォームの存在が関連している。がん細胞はグルコース消費の増大を示すが、ピルビン酸キナーゼM2の存在は、通 常は正常な分化組織にみられるM1アイソフォームの存在下に比べて、酵素活性の低下と関連する。HunterとPerrimonの両者は、このパラドック スを探究し、アデノシン三リン酸の産生を制限することによってがん細胞に解糖系のフィードバック抑制を回避させうる別の解糖系を発掘したVander Heidenら(14)の論文を推薦した。Fangら(15)の研究は、ワールブルク効果にさらなる洞察を与えるもので、小胞体酵素ENTPD5(細胞外ATP加水分解酵素 5)の発現および活性の増大を介して、腫瘍抑制因子PTENの減少に続くプロテインキナーゼAktの活性増大を好気性解糖系と関連づけた。
悪性グリオーマは通常、細胞質酵素であるイソクエン酸脱水素酵素1(isocitrate dehydrogenase 1:IDH1)に変異を抱えているため、イソクエン酸からaケトグルタル酸への変換を触媒できない。とくに、これらの変異は腫瘍細胞の単一の対立遺伝子の みに存在する。Hunterの次の推薦では、発癌性代謝物2-ヒドロキシグルタル酸を産生する機能の能力が予想外に獲得(正常機能の消失ではなく)したこ とを、IDH1(とそのミトコンドリア相同体であるIDH2)の変異のがん発病への寄与に関連づけ、根底にある機構を解明した1対の論文(16、17)が提示された。
がん細胞は、異常代謝と関連のない多数の異常を示し、当然ながら、その一部は古典的なシグナル伝達経路とより密接に関連する。多くの がんでは、RasからRaf、MEK(マイトジェン・細胞外シグナル制御プロテインキナーゼキナーゼ)、ERK(細胞外シグナル制御プロテインキナーゼ) を介したシグナル伝達であるMAPK(マイトジェン活性化プロテインキナーゼ)シグナル伝達経路の亢進がみられるが、この経路は分裂促進刺激の下流で機能 する。Rasを活性化する変異は、多様ながんでよくみられ、RafのBRAFアイソフォームの活性化変異はメラノーマでとくに顕著である。しかし、ヒトメ ラノーマでみられる一部のBRAF変異は、触媒として不活性である。Perrimonは、触媒として不活性なBRAFが自己抑制能を失うこと、また、構成 的活性型Rasとともに発現された場合には、Rasと協同してRafのCRAFアイソフォームを過剰活性化することによってMEKとERKを介したシグナ ル伝達を亢進させることを示すことによってこの明らかなパラドックスを解明したHeidornら(18) の論文を推薦した。Perrimonの指摘どおり、これらの知見は腫瘍発生の根底にある基礎機構について洞察を与えるだけでなく、BRAF阻害薬が発癌性 Rasを含む腫瘍でもCRAFを介したシグナル伝達を亢進させたことから、BRAFメラノーマの治療にとっても、相当な意味をもつ。
遺伝学は、代謝と同様によく研究された生物学領域であるが、代謝と同様に、予想外の発見をもたらす余地を依然として残している。ヒト トランスクリプトームの驚くべき大部分がタンパク質をコードしていない。マイクロRNAなどの低分子RNAに制御機能があることは十分に確立されており、 これらの非コードRNAの新たな機能が次々に明らかになっている。しかし、コード遺伝子に似ていながらも多様な変異(中途終止コドンやフレームシフトな ど)を獲得したせいでタンパク質をコードできない偽遺伝子は、ほとんど機能を失っているものとみなされてきた。Frumanは、発現された偽遺伝子が調節 性マイクロRNAと競合することによってがん関連パートナー遺伝子の発現を制御しうることを示し、調節性偽遺伝子に発癌または腫瘍抑制因子機能を与えた Polisenoら(19) の論文を推薦した。Frumanの説明どおり、「偽遺伝子が過剰発現されるとマイクロRNAのデコイ(囮)が供給されることによってパートナー遺伝子の発 現は亢進され、逆に、偽遺伝子の発現が減少するとパートナー遺伝子の発現も減少する。概念実証として、著者らは腫瘍抑制因子PTENの偽遺伝子パートナーであるPTENP1の腫瘍抑制因子機能を示した。同様に、偽遺伝子KRAS1Pはがん遺伝子KRASの発現を亢進する。この新たな知見は、シグナル伝達の出力を調節する新たな機構を提供するものであり、腫瘍生物学にとっても、そしておそらく他の生理学的系にとっても、重要な意味がある」。
細胞シグナル伝達のさらなる理解が療法の改善につながる可能性のある疾病はがんのみではなく、HunterとSnyderは、他の2 つのヒトの災難である糖尿病とアルツハイマー病のよりよい治療につながる可能性のあるブレイクスルーを推薦した。がんと同様、2型糖尿病には代謝異常が関 連する。肥満と代謝症候群と、インスリン抵抗性に関連する2型糖尿病との間に関連があることはよく知られている。核受容体 PPARg(peroxisome proliferator-activated receptor g、ペルオキシソーム増殖因子活性化受容体g)を活性化する薬物は、インスリン感受性を増大させるため、糖尿病の治療に利用されている。ただし、 PPARg作用薬は有害な副作用をもつ可能性があり、また、奇妙なことに、インスリン感受性を高める能力はPPARgを活性化する能力と相関しない。 Hunterは、これらの薬物が古典的なPPARg作用薬とは異なる機構、代わりにCdk5(cyclin-dependent kinase 5、サイクリン依存性キナーゼ5)によるPPARgの活性化リン酸化を阻害する能力に依存した機構によって作用するらしいことを示し、より優れた抗糖尿病 薬の開発につながる可能性のある発見となったChoiら(20)の論文を推薦した。
アルツハイマー病に関連する神経毒性ペプチドであるbアミロイドの蓄積に関与するタンパク質分解酵素gセクレターゼを標的とする薬物 を開発する努力は、gセクレターゼが多数の基質をもつという事実によって混乱させられてきた。このジレンマをすり抜ける道となる可能性のあるHeら(21) の研究を推薦するにあたって、Snyderは「製薬会社はこの酵素の阻害薬を探し求めてきたが、この酵素は発生におけるNotch経路にも関与しているた め、これまでに同定された阻害薬には毒性がある。Greengardの研究チームは、Notchに関与せず、この酵素の活性を大幅に亢進するgセクレター ゼ活性化タンパク質(g-secretase activating protein:GSAP)と呼ばれる新たなタンパク質を発見した。GSAPを阻害する薬物はNotchシグナル伝達に影響することなくアミロイドbペプ チドを減少させる」と説明した。
Snyderは、彼のM.D./Ph.Dの学生Moe Gadallaとの連名で、さまざまな神経変性疾患にとって、さらに広くは再生医療の分野にとって重要な意味をもつVierbuchenら(22) の研究を推薦した。発生中の細胞系統のコミットメントは、不可逆的過程として考えられてきた。われわれが2007年に報告したブレイクスルーのうちの1つ が、限定された少数セットの転写因子を用いて体細胞を多能性幹細胞へと戻すリプログラミングが可能であるという発見であった。Snyderの指摘どおり、 今回の論文は、非神経系統の細胞(マウス胚性または出生後の尾部先端の線維芽細胞)を機能性ニューロンへと直接的かつ効率的に変換するためには3つの転写 因子をコードする遺伝子の混合(Ascl1、Brn1、Myt1l)で十分であることを示した点において、「さらに1歩進んだ」論文である。幹細胞段階を迂回することから、この手法は、損傷や疾患で失われた神経と置換するための患者特異的ニューロンを産生できる可能性を秘めている。
闘病のための療法の改善は画期的なシグナル伝達研究の胸躍る成果となりうるが、最初から病気にならずに済むほうがより好ましい。もち ろん、これは免疫系の仕事であり、免疫系はひょっとすると複雑さにおいて神経系に匹敵する体内で唯一の系かもしれない。Vivierは、免疫系がこれまで 考えられていたよりもさらに複雑であることを明らかにした一連の論文(23〜32) を推薦した。これらの論文は、同種の集団として存在するのではなく、腸の粘膜関連リンパ組織の自然リンパ球細胞には恐ろしいほどの不均一性が存在すること を示し、この多様な細胞型がそれぞれの機能と産生するサイトカインに基づいて分類可能であることを確認したものである(図3)。
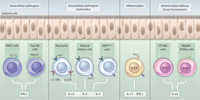
図3.
腸の自然リンパ球細胞。腸の粘膜関連リンパ組織を構成する自然リンパ球細胞は、さまざまなマーカーによる同定が可能で、それぞれの機能と産生するサイトカ インに基づいて分類できる。MAIT(mucosal-associated invariant T lymphocytes、粘膜関連インバリアントTリンパ球)細胞と腸NK細胞は、gインターフェロン(IFN-g)を産生し、細胞内の病原体に対する防 御に関与する。Nuocyte、Natural Helper Cell(ナチュラルヘルパー細胞)、MPPtype 2(multipotent progenitor type 2、多能性前駆細胞2型)細胞は、インターロイキン(interleukin:IL)-4、IL-5、IL-13を産生し、蠕虫などの細胞外の病原体に対 する防御を仲介する。Thy-1、幹細胞抗原1(stem cell antigen 1:SCA-1)、レチノイン酸関連オーファン受容体(retinoic-acid-related orphan receptor:ROR)-gtを発現し、IL-17を分泌する自然リンパ球細胞の集団は、炎症応答と関連づけられている。リンパ組織誘導 (lymphoid-tissue inducer:LTi)様細胞とNKp46+、RORgt+の細胞は、IL-22を分泌し、抗菌機能がありながら粘膜組織のホメオスタシスにも関与して いるようである。この後者の集団は、細胞表面NKp46受容体、インバリアントT細胞受容体a鎖であるiVa 7.2、c-kit受容体チロシンキナーゼ大量中間体であるc-kitintを発現する点で腸NK細胞に類似している。
[CREDIT: Y. HAMMOND/SCIENCE SIGNALING]
最後に紹介する一連の推薦では、その焦点を分子レベルに移している。Dohlmanは、ヘテロ三量体グアニンヌクレオチド結合タンパ ク質のGqファミリーのGaサブユニット(Gaq)がそのエフェクターホスホリパーゼC-b(PLC-b)を活性化し、そうすることで不活性化される機構 (図4)を探究したWaldoら(33) の論文を推薦した。「すべての神経伝達物質シグナル伝達(とくに血圧の神経伝達物質制御)の約半分は、Gタンパク質のGaqクラスに仲介される。他のGタ ンパク質と同様、Gaqは活性化と不活性化のサイクルを繰り返し、各段階はそれぞれ、受容体とRGSタンパク質によって加速される。また、Gaqは、その エフェクター酵素であるホスホリパーゼC-bと結合すると不活性化される。そのため、シグナル伝達を促進する共役がシグナル伝達を抑制する役割も果たして おり、この現象は『動態学的足場』として知られている」。PLC-b3と複合体を形成中のGaqの結晶構造によって、動態学的足場の分子基盤が明らかにさ れている。また、まったくの予想外に、その構造から、Gタンパク質とRGSタンパク質の複合体とのわずかながらも機能的に重要な類似性が明らかにされた。 そのため、配列類似性は完全に欠如しているにもかかわらず、PLC-b3とRGSタンパク質は分子レベルにおいて全く同じ方法で作用しているようである。 この知見は、神経伝達物質シグナル伝達に対するこれらの根本的な重要性を示すものとしてだけでなく、収束進化の顕著な例としても注目に値する。
今年の推薦ではユビキチン化が大いに注目されたが、おそらくもっとも馴染みのある、いや、あえて言えばもっとも愛されている翻訳後修 飾は、依然としてリン酸化だろう。最後の3つの推薦は、いずれもHunterによる推薦であるが、キナーゼ制御、特異性、機能に関するある驚くべき発見に 関係した。1つ目の推薦は、Escherichia coli(大腸菌)酵素であるイソクエン酸脱水素酵素キナーゼ/ホスファターゼ(AceK)の構造について報告したZhengとJiaの論文(34) に対するものであった。もっとも原始的なプロテインキナーゼの1つであることを考慮すれば、AceKにはイソクエン酸脱水素酵素を阻害するキナーゼまたは 活性化するホスファターゼのいずれかとして機能するための注目すべき能力が備わっている。イソクエン酸脱水素酵素の阻害は、イソクエン酸をグリオキシル酸 へと転換し、それによってクレブス回路の一部を迂回する。AceKは、多数の低分子によるアロステリック制御の対象であり、構造解析および変異解析によっ て、著者らはそのキナーゼ活性とホスファターゼ活性の切替の制御機構を提示することができた。非受容体チロシンキナーゼSyk(spleen tyrosine kinase、脾臓チロシンキナーゼ)は、B細胞受容体(B cell receptor:BCR)シグナル伝達、Ig-aの免疫受容活性化チロシンモチーフ(immunoreceptor tyrosine-based activation motif:ITAM)、BCRシグナル伝達経路を仲介する他のさまざまなタンパク質のチロシン残基のリン酸化において突出した役割を果たす。 Heizmannらの論文(35) は、AceKと同様にSykが多機能であること、ただしキナーゼおよびホスファターゼとして作用するのではなく、二重特異性キナーゼとして作用し、チロシ ン残基のほかにセリン残基のリン酸化も可能であることを明らかにした。mTOR(mammalian target of rapamycin、哺乳類ラパマイシン標的タンパク質)キナーゼは、ひょっとすると、われわれのシグナル伝達のブレイクスルー特集でもっとも顕著に注目 されてきた単独酵素かもしれない。今年もこの記事の締めくくりは、mTOR機能に関するOhらの論文(36) への推薦である。細胞の成長と増殖を制御するために増殖因子の存在量、エネルギー状況、栄養素の利用性に関する情報を調和させるmTORは、独特な複合体 mTORC1とmTORC2を介してシグナルを送る。mTORC1を介して作用すると、mTORは翻訳開始因子とリボソームタンパク質をリン酸化し、翻訳 開始を促進する。Ohらの論文は、mTORC2がリボソームに付随し、翻訳中の新生Aktペプチドをリン酸化し、それによって適切な折り畳みを確実なもの とし、mTORがタンパク質翻訳と共役して質管理を行えるようにしていることを示している。
今年の推薦は、シグナル伝達研究が依然として面白く、しかも生物医学的に意味のある領域であること、また、還元主義者レベルからシステムレベルまで、数多くの生物学的分野、およびさまざまな研究手法から新たな洞察が生まれ続けることを示している。
E. M. Adler, 2010: Signaling Breakthroughs of the Year. Sci. Signal. 4, eg1 (2011).
2011年1月4日号