ラクトフェリンはさまざまな外分泌液や好中球から分離できますが、本章では牛乳を材料とします。牛乳からラクトフェリンを精製するには、おおよそ下記の手順によります(図1-1)。ここで脱脂乳のpHを酸性にしてカゼイン成分を分離する方法が等電点沈殿法です。また、牛乳は出来得る限り新鮮なものを用います。やむを得ず搾乳してから数日以上保管しなければならない場合は、なるべく脱脂乳として低温あるいは冷凍保存します。脱脂には3000 rpm程度の遠心操作で十分ですが、牛乳の温度を32-38℃とすると脂肪の分離効率は良くなります。
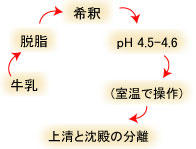
図1-1.牛乳からホエー(乳清、wheyまたはmilk serum)とカード(curd、沈殿物の部分)を得るための操作の流れ (冷たい脱脂乳で上記操作を行うと、カードが沈殿せずに浮上するので注意)
ここで得られる上清(酸ホエー)のpHを中性に戻し、陽イオン交換樹脂に吸着するラクトフェリンを分離します。通常は得られるホエーの容量が数リットルになるので、中性pHでイオン強度が比較的小さい緩衝液(吸着用緩衝液あるいは平衡化緩衝液という)で平衡化した陽イオン交換樹脂をホエー中に懸濁させて穏やかに撹拌し、目的成分を樹脂に吸着させます。次いで樹脂を平衡化緩衝液で数回洗浄しますが、この時はガラスフィルターを用います。洗浄した樹脂をクロマトグラフィー用カラムに充填し、溶出用緩衝液の塩濃度を段階的に上昇させることにより、吸着している成分を順次溶出させます(図1-2)。
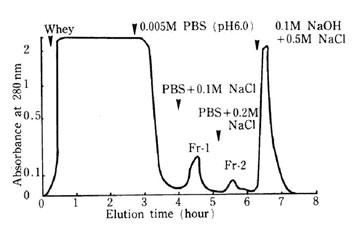
図1-2.ホエーからのCM-Toyopearlによるラクトペルオキシダーゼ(Fr-1)、ラクトフェリン(Fr-2)の分離1)
肉眼でも薄緑色、次いで薄赤色を帯びた溶液がカラムの中で帯状になって現れ、最後にカラムから溶出するのが観察されます。前者がラクトペルオキシダーゼ(lactoperoxidase)、後者がラクトフェリン(lactoferrin)を含んでいる画分です。しかしそれらの画分の前後にも、着色していない成分が溶出しています。これらは紫外部での吸光度、あるいは他のタンパク質定量法を用いて検出します。一般にはフローセルを用いた吸光度モニターで連続的に測定しますが、フラクションコレクターで各画分を分取した後、個別定量法を用いる場合もあります。
なお、使用前後のイオン交換樹脂の洗浄と平衡化は必須です。用いるイオン交換樹脂にもよりますが、0.1 M NaOH + 1 M NaClの溶液で洗浄し、平衡化には目的pHで高イオン強度の緩衝液を最初に用い、順次イオン強度を最終濃度まで下げるなどの操作を行います。また、pHおよびイオン強度によってタンパク質の荷電状態が変化するため、対象タンパク質の電気的性質および分離規模を考慮し、吸着担体であるイオン交換樹脂をはじめクロマトグラフィーの条件を適切に選択しなければなりません。
その他のクロマトグラフィーによる分離
上記の方法で得られたラクトフェリンを電気泳動法(SDSポリアクリルアミドゲル電気泳動が一般的)によってその純度を調べると、不要な成分がかなり混入している場合があります。そのため、イオン交換クロマトグラフィーを再び行うか、あるいは分離の原理が異なるクロマトグラフィー、たとえばゲルろ過クロマトグラフィーやアフィニティークロマトグラフィーを行なって、さらに不純物を除きます。精製の段階が進むに従い、目的物の収量が減少するので、それに応じて精製に用いるカラムカイズや検出感度も適合させることが必要です。イオン交換クロマトグラフィーあるいはアフィニティークロマトグラフィーにおいてはpH、塩濃度あるいは他の組成を変化させて吸着成分の溶出を行ないます。この場合、段階的に変化させる段階溶出法 (stepwise elu-tion) の他に、連続的に変化させる濃度勾配溶出法 (gradient elution) も用いられます。どちらの溶出法が適しているかはカラムの規模や目的によって異なります。なお、塩濃度を変える場合には一般にはNaClを用いますが、KClを用いた場合は同じ濃度でも約1.5倍の効果が期待できます。濃度勾配溶出法を行う場合、おおよそカラム容積の10倍程度の溶出量で終了するように条件を設定します。また、溶出物が全く検出されなくなる時点がクロマトグラフィーの終了ではありますが、分取目的の場合は目的物の溶出が終了した時点で切り上げ、再クロマトグラフィーでさらに精製する方が合理的です。
ゲルろ過クロマトグラフィーでVo (void volume) を求める場合、ブルーデキストランを用います。しかし肉眼では識別できませんが、少量の遊離した色素がカラム内に残ります。その後ラクトフェリンをカラムに添加して溶出すると色素がラクトフェリンに結合して一緒に溶出することを経験しました2)。
一般にイオン交換クロマトグラフィーで目的画分を得た後にゲルろ過クロマトグラフィーを行なおうとすると、濃縮操作で試料容積を少なくしなければなりません。希釈するのは容易ですが濃縮操作がかなり困難な仕事であることは、熱力学的な説明を持ち出すまでもありません。限外ろ過(ultrafiltration)による濃縮方法はその一つです。孔径が10-200 nmのフィルターの片側から試料液に圧力をかけて分別するもので、分画する対象物質によって膜孔の径を選択します。一般に分画範囲(分子量)として表示されている数値は、その90%が保持されることを意味しています。膜による分画は目的物質の流体力学的な性質、すなわちストークス半径で決まるので、分子量だけではなくその形状にも依存します。また、限外ろ過装置は数十リットル規模から1 ml程度までのものがあります。試料液に圧力をかけるにはコンプレッサーや窒素ガスボンベ、あるいはペリスタポンプを用いますが、数ml規模の限外ろ過には遠心式のものが便利です。ある程度濃縮された溶液に緩衝液あるいは水を加えて再び濃縮することを繰り返すと、溶媒交換あるいは脱塩操作となります。希薄なタンパク質溶液が大量にある場合、イオン交換樹脂にバッチ法あるいはカラムを用いて吸着させ、目的物の溶出条件よりやや厳しい条件で一度に溶出させた後、脱塩あるいはpH調整を行う方法も手間が少なく有効です。
硫酸アンモニウムを加えることによってタンパク質を沈殿させる方法もありますが、大量の希薄溶液では遠心操作も多くなり、かつ微粒子が沈殿しないで懸濁している程度の場合は回収率も良くありません。数十ml程度の容量の場合は、透析チューブに試料液を入れ、ショ糖などの不活性で溶解性の高い物質で被い、やや圧迫気味にして低温に置いておく方法もあります。この方法で濃縮した試料はそのままゲルろ過クロマトグラフィーカラムでの分離に用いるのに最適です。同様な原理で濃縮する市販品として、試料液中の溶媒を限外ろ過膜を挟んだ吸湿剤に吸収させるものもあります。
タンパク質の精製操作には数日以上を要するため、操作を中断する場合には目的物が安定な形、たとえば沈殿状態などの時に低温あるいは凍結で保存します。いづれにしろクロマトグラフィー操作の中断は避けなければなりません。なお、最終的に得られた目的タンパク質は、適切な緩衝液に溶かして次の操作あるいは測定まで冷蔵または冷凍保存します。タンパク質溶液を透析操作 (dialysis) によって脱塩(desalting) し、凍結乾燥 (freeze-drying、lyophilization)もよく行われます。タンパク質は生もので、腐敗し易くまた混在するタンパク質酵素の作用を受けるため、一般に分離操作は低温で行います。細胞や組織からの分離で、特にタンパク質分解酵素の混在が心配される場合には各種の酵素阻害剤を添加して分離操作を行います。























