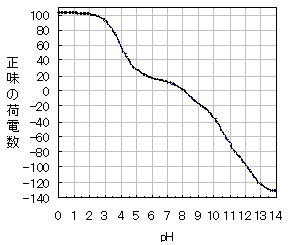
前章で述べたように、ラクトフェリンを分離する第一段階として、陽イオン交換樹脂による分離法を用いました。これはラクトフェリンが電解質としての性質を示し、かつその等電点(pI)が塩基性側にあるためです。他のミルクタンパク質、たとえばカゼインやαラクトアルブミン、βラクトグロブリンなどは等電点が弱酸性側にあるので、一般には陰イオン交換樹脂に吸着させて分離します。なお、タンパク質の等電点はそれらのアミノ酸組成から計算で求めることが出来ますが、実測値とは異なる場合もあります。
得られた目的タンパク質の純度を求める方法はいくつかあります。一つは目的画分を再度クロマトグラフィーによって分析し、分析した物質全量に対する目的物質の割合を求める方法です。簡便にはクロマトグラフィーパターンで得られる全ピーク面積に対する目的物質のピーク面積の割合から純度を算定します。しかし、これはあくまでもクロマトグラフィー的に求めた純度であり、他の手段による検定も必須です。たとえば前節で触れたように、SDS-ポリアクリルアミドゲル電気泳動法(SDS、sodium dodecyl sulfate)を用いることが一般に行われています。しかし、これもあくまでも電気泳動的に見て均一かどうかということで、その方法の限界を知ってデータを解釈しなければなりません。解離基を持つアミノ酸残基の置換があるタンパク質、たとえば酵素(アイソザイム)の検出には、変性剤であるSDS を加えた電気泳動法ではなく、変性剤を含まない担体を用いる電気泳動法 (native electrophoresis) あるいは等電点電気泳動法 (isoelectrofocusing)が用いられます。また、これらゲル電気泳動法で検出されたタンパク質バンドの割合を定量化するには、染色バンドを切り取り色素を抽出して比色定量したり、ゲルを光学的にスキャンするデンシトメーターが用いられていましたが、現在はデジタルカメラ(CCDカメラ)でゲルの画像を撮影し、それを専用のソフトウエアで定量化するのが一般的です。
ラクトフェリンの場合、クロマトグラフィー操作によってかなり純度をあげたつもりでも、SDS-電気泳動法で観察すると主成分に比べて移動度の大きなバンドが複数で観察されることがあります。そこで第4章で述べる抗ラクトフェリン抗体を用いた検出法(Western blot)を行うと、やはり抗ラクトフェリン抗体と反応性を示す場合があります。そのようなバンドはラクトフェリンから何らかの原因で生じたフラグメントと考えられています。
タンパク質に対するSDSの結合量が異なると電気泳動での移動度が変化します。これは特に酸性アミノ酸残基やリン酸基の多いタンパク質で顕著です。牛乳タンパク質の内カゼインがSDS-電気泳動法で異常な挙動をするために、この方法で分子量を推定する際には注意が必要です1)。
ゲル電気泳動後のタンパク質は、拡散しないように酢酸やメタノール溶液で固定化され、タンパク質結合性の色素による染色で可視化します。この際に留意することは、用いる色素さらには同じ色素でも溶媒によってタンパク質結合量が変化し、タンパク質バンドのパターンが異なって観察されることがあるということです(図2-1参照)。色素染色法に比べて格段に感度の良いとされる銀染色法でも、対象タンパク質によってはそれほどでもないことがあり、また逆にタンパク質量が多過ぎると検出バンドが白く抜けてしまいます。電気泳動後のゲルからニトロセルロース膜あるいはPVDF膜にタンパク質を転写し、膜上でタンパク質を検出することも行われます。これら膜に転写したタンパク質バンドを検出するには、やはり各種の色素による染色法が用いられます。しかし、銀染色法は不適なため、金コロイド法が用いられます。簡便で感度も高い方法です。
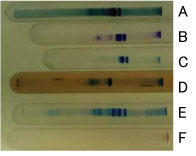
図2-1.SDS-PAGE(ディスク法)によるウシホエータンパク質の色素染色による検出。
泳動方向は向かって右から左へ。なお、溶媒によってゲルの伸縮があるが、補正していない。
A, アミドブラック10B / 7%酢酸
B, 0.25% クマシーブリリアントブルー(CBB) R250 / メタノール:酢酸:水(5:1:5)
C, 0.25% CBB G250 / メタノール:酢酸:水(5:1:4)
D, 0.04% CBB G250 / 3.5% 過塩素酸
E, 0.08% CBB G250 / 0.4 M 硫酸 / 1.1 M KOH/11.3% トリクロロ酢酸2)
F, PAS染色
クロマトグラフィーの各段階で得られた画分にタンパク質がどれだけ含まれているかを定量するには、さまざまな方法があります。紫外部280nmでの吸光度から求める方法は簡便かつ試料も回収できるため無駄になりません。しかし、試料が他の紫外線吸収物質を含む場合には問題となります。また、分子吸光係数 (E1%,1cm)が報告されていない場合は濃度を吸光度から求めることはできませんが、この値は一般には10前後です。試料が還元糖やその他の還元物質を含む場合には、Lowry法やBCA法など銅の還元反応が関与する方法は使用できません。色素結合法もやはり妨害物質の存在には留意しなければなりません。これら呈色反応による定量法では標準タンパク質を用いた検量線の作成が必要ですが、もちろん純粋な目的タンパク質を用いて検量線を作成するのが最も望ましいことです。
タンパク質の分子量を正確に測定する方法として、分析用超遠心分離装置を用いた沈降平衡法や光散乱法が用いられていました。粘性係数や拡散係数、沈降係数など、熱力学的にも裏付けされたこれら流体力学的な測定方法は、標準物質との比較で分子量を求める相対法すなわち電気泳動法やゲルろ過クロマトグラフィー法に比べて理論的にもはるかにしっかりした方法です。しかし、装置の価格と操作の簡便さの点では雲泥の差があり、現在は分子量を求める方法としては使われていません。代わって最近は質量分析計(MALDI TOF MS)が使われることが多くなりました(第7章参照)。