金ナノ粒子コンジュゲート は、生物学的分野やバイオセンシング用途に幅広く応用されています。例えば、光学顕微鏡や電子顕微鏡、ラテラルフロー 法、ドットブロットのような イムノブロット でプローブとして用いられます。
金ナノ粒子コンジュゲートを調整する方法には、受動吸着による方法と、架橋剤を介した共有結合による方法の二種類があります。受動吸着は比較的簡便な調整方法で実施可能ですが、標識分子は時間の経過と共に脱離する可能性があるため、永久的なコーティングには適しません。加えて、表面への吸着後、標識したタンパク質の三次構造の変化や活性部位または抗原部位の金粒子表面への結合によって、標識タンパク質の活性が失われる場合があります。
受動吸着法はこのような欠点があるものの、簡便に金ナノ粒子コンジュゲートを調製できるため、一般的な手法として定着しています。受動吸着 による標準的な球状金ナノ粒子のタンパク質コンジュゲートの調製には、「金ナノ粒子コンジュゲート調製の最適化キット」が最適です。
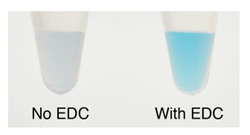
受動吸着法と比較して、共有結合による標識法は、目的分子を官能化金ナノ粒子(例えば、カルボキシル基またはアミン基を有する)へ永続的に固定化することができます。したがって、受動吸着法よりも安定的なタンパク質標識が可能です。共有結合に標識は、特定の官能基と反応する架橋剤(例:EDC/NHS試薬)を使用します。この反応は、受動吸収法よりも特異的で制御しやすく、共有結合するリガンド数は特定のアプリケーションに最適化できます。また、共有結合プロセスによるタンパク質の三次元構造に与える影響は最小限で、標識するタンパク質の特性および活性が維持されます。
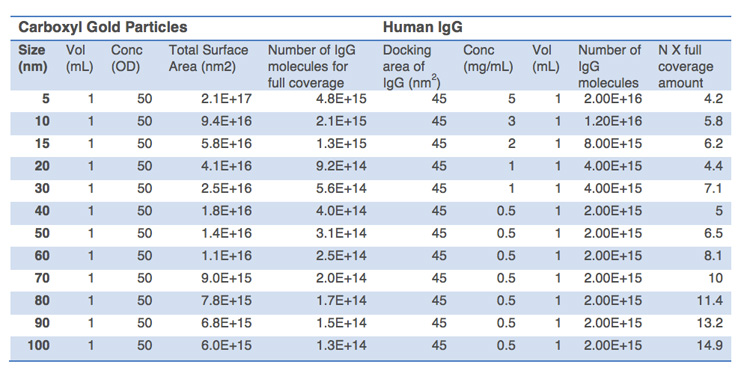
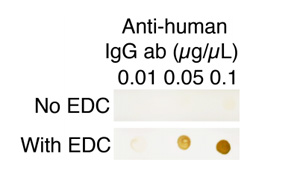
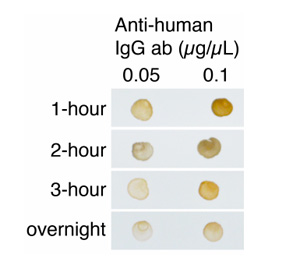
全てのカルボキシル基修飾金ナノ粒子、金ナノアーチン、金ナノロッド製品は、結合のためにEDC/NHS反応を利用します。EDC/NHSは粒子表面のカルボキシル基を「活性化」し、中間体を形成させます。中間体は、その後標識する特定のタンパク質やリガンド中に存在する一級アミンと反応します。EDC標識の効率は一般的に低く pH に敏感で、一定の性能と安定性を得るためには、共有結合プロトコルの最適化が必要になります。以下のプロトコルでは、一例としてCytodiagnostics 社カルボキシル基修飾金ナノ粒子への体生体分子結合の一般的なガイドラインを紹介します(一例として、20nmのカルボキシル基修飾金ナノ粒子への標準のIgGの結合を記載します)。他の種類の生体分子やナノ粒子では、最適な標識条件が異なる場合があります。粒子表面への最大の結合効率を得るためには、完全に標識するのに必要な理論上のタンパク質量に対して、約1〜10倍過剰に必要です。