がん関連抗体
がんの特徴
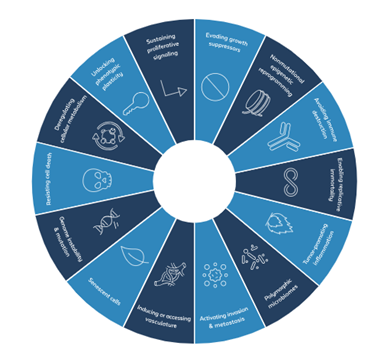
2000 年、Douglas Hanahan氏と Robert Weinberg氏は「がんの特徴」という論文を発表し、正常細胞から悪性細胞への多段階変化を統括している6つの基本ルールを概念化しました。20年以上経ち3回目の更新版「がんの特徴:新たな次元」では、これらの最初の6つ特徴が14にまで拡大されました。これらの特徴は、詳細な特徴を同定し、それらが互いにどのように相互作用するかを説明することによって、正常細胞が悪性腫瘍にどのように発展するかを説明する一連の基準を概説しています。これらの特徴には、持続的な増殖シグナル伝達、増殖抑制因子の回避、細胞死への耐性、無限の複製能力、血管新生、ゲノムの不安定性などがあります。これらの特徴が組み合わさることで、がん細胞は細胞の成長と分裂を調節する正常な制御を回避し、分裂と増殖を続け、近くの組織に侵入して体の他の部分に広がる腫瘍を形成することができます。以下に、それぞれの特徴の概要、関連リソース (経路の図など)、研究ツール (抗体、ELISA キット、リコンビナントタンパク質など) を示します。
- 増殖シグナルの持続
- 成長抑制因子の回避
- 細胞死に対する耐性
- 腫瘍を促進する炎症
- 複製による不死化の実現
- 老化細胞
- 細胞代謝の調節異常
- 免疫破壊の回避
- 血管系への誘導またはアクセス
- 浸潤と転移の活性化
- 表現型の可塑性の解明
- ゲノムの不安定性と変異
- 非突然変異性エピジェネティックなリプログラミング
- 多形性マイクロバイオーム
1. 増殖シグナルの持続
がん細胞の最も基本的な特性は、慢性的な増殖を持続する能力です。これは、細胞の成長と分裂を促進するシグナル伝達経路を活性化するがん細胞の能力を指します。通常、これらの経路は厳密に調節されていますが、がん細胞では、これらの経路が常に活性化されているため、通常の成長シグナルがない場合でも細胞は分裂と増殖を続けることができます。これは、これらのシグナル伝達経路に関与するタンパク質をコードする遺伝子の変異の結果である可能性があり、細胞の成長を促進する下流のシグナル伝達分子の活性化につながります。
2. 成長抑制因子の回避
がん細胞における増殖シグナル伝達を維持するための非常に補完的でかつ特徴的な能力は、成長抑制を回避する能力です。成長抑制遺伝子は通常、細胞の成長と分裂を阻害する働きをします。細胞の成長と増殖を抑制するために多様な働きをする、いくつかの腫瘍抑制タンパク質をコードしている遺伝子が発見されています。顕著な例としては、網膜芽細胞腫タンパク質 (RB) またはヒト腫瘍抑制因子 p53 があります。転写因子は、細胞周期の調節、アポトーシスの誘導、または DNA損傷後のDNA修復に関与する遺伝子の発現を制御しています。がん細胞では、これらの遺伝子は、その機能を無効にする変異または発現を妨げるメカニズムによって不活性化されることがよくあります。これにより、がん細胞は細胞の成長と分裂に対する通常の制約を回避し、抑制されずに増殖し続けることができます。
3. 細胞死に対する耐性
がん細胞は、成長抑制因子を回避するだけでなく、細胞死に対する高い耐性も持っています。通常、細胞は損傷を受けたり不要になったりすると、プログラムされた細胞死、つまりアポトーシスを起こします。がん細胞は、損傷や異常を検出するメカニズムを変え、適切なシグナル伝達とアポトーシスの活性化を妨げます。がん細胞は、下流のシグナル伝達自体または関連するタンパク質に欠陥を引き起こす可能性があり、これも適切なアポトーシスを妨げます。これは、アポトーシス経路を調節する遺伝子の変異の結果である場合もあれば、細胞の生存を促進するシグナル伝達経路の活性化が原因である場合もあります。
4. 腫瘍を促進する炎症
炎症はがんの発症を促し、腫瘍形成のすべての段階を促進します。感染に対する免疫を媒介し、組織のホメオスタシスを促進するために発達した経路は、腫瘍に奪われて利用されます。がん細胞、および周囲の間質細胞と炎症細胞は、炎症性腫瘍微小環境 (TME) を形成します。さらに、炎症は腫瘍の成長をサポートする成長因子の放出を誘発します。 初期の炎症反応が誘発されるメカニズムはいくつかあります。例としては、発がん性細菌、環境汚染物質、肥満に関連する低レベルの炎症、および片利共生細菌に関連する上皮バリアの劣化があります。がんに関連する炎症のタイミングもさまざまです。関連する原因と刺激は、自己免疫、感染症、または悪性細胞です。炎症は、抗がん療法自体によって引き起こされることもあります。
5. 複製による不死化の実現
無制限に複製できる可能性は、腫瘍の発生におけるもう1つの重要な側面であり、これもがんの特徴として認識されています。ヒトの体の細胞とは対照的に、がん細胞は「ヘイフリック限界」を克服し、通常の細胞老化プロセスを経ることなく、無限に分裂することができます。通常、老化または細胞死の状態に入った細胞は複製を停止します。これは主に、染色体の末端にあるテロメアと呼ばれる DNA によるものです。テロメア DNA は細胞分裂のたびに短くなり、短くなりすぎると老化が活性化され、細胞は分裂を停止します。がん細胞は、テロメラーゼという酵素を操作してテロメアの長さを長くすることで、この障壁を回避します。したがって、がん細胞は老化を開始することなく、無限に分裂することができます。
6. 老化細胞
細胞老化は、栄養欠乏や DNA損傷などの微小環境ストレス、細胞小器官や細胞インフラストラクチャーの損傷、細胞シグナル伝達ネットワークの不均衡など、さまざまな条件によって誘発されます。 細胞老化は長い間、がん細胞が老化するように誘導する腫瘍に対する保護メカニズムであると考えられてきました。上記のトリガーの大部分は悪性腫瘍に関連しており、特に異常な過剰増殖の結果としての DNA 損傷は、過剰活性化シグナル伝達によるがん遺伝子誘発性老化としても知られています。しかしながら、新しい文献はこの直線的な相関関係に疑問を投げかけています。特定の状況では、老化細胞はさまざまな方法で腫瘍の発生と悪性進行を刺激します。老化細胞が腫瘍表現型を促進する主なメカニズムは、細胞老化関連分泌現象 (SASP) によるものと考えられています。
7. 細胞代謝の調節異常
腫瘍は、妨げられることなく成長するために、細胞増殖の無秩序な制御だけでなく、細胞の成長と分裂を促進するためのエネルギー代謝の調整からも恩恵を受けています。腫瘍は、細胞代謝を変更またはリプログラムして、腫瘍の増殖を効率的にサポートすることができます。好気条件下では、正常な細胞は、まず細胞質で解糖によりグルコースをピルビン酸に、次にミトコンドリアで二酸化炭素に処理します。嫌気条件下では、解糖が優先され、酸素を消費するミトコンドリアに送られるピルビン酸は比較的少量です。Otto Warburg 氏は、がん細胞におけるエネルギー代謝の異常な特徴を初めて観察しました。
8. 免疫破壊の回避
一部のがん細胞は、免疫監視と宿主の免疫系による攻撃の両方を回避するメカニズムに適応しています。細胞がこれを行う方法の1つは、免疫チェックポイント制御の正常なメカニズムを乗っ取ることです。免疫チェックポイントとは、自己免疫寛容を維持し、生理学的免疫応答中に付随的な損傷を回避するのに役立つ、免疫システムに組み込まれている制御メカニズムを指します。腫瘍特異的T細胞は、腫瘍細胞の破壊と標的細胞の生存を識別する必要があります。識別に重要なのは、T細胞と標的細胞の両方にあるタンパク質です。腫瘍細胞は、Tリンパ球のアポトーシスを誘導する分子もしくはTリンパ球を阻害する分子を発現します。例えば、腫瘍細胞の表面にある PD-L1 は、T リンパ球の抑制を引き起こします。一方、FasL はTリンパ球のアポトーシスを引き起こす可能性があります。一部のがん細胞は、抗腫瘍免疫の基本要素である細胞傷害性 CD8+ T 細胞に対する耐性を獲得しようとします。これらは MHC I の発現を低下させ、細胞傷害性T細胞に検出されないようにしています。アポトーシスシグナル伝達経路分子の破壊も、腫瘍による免疫回避の成功につながります。カスパーゼ 8、Bcl-2、または IAP などが主な標的です。
9. 血管系への誘導またはアクセス
拡大する腫瘍は、成長と拡散を維持するために栄養素の必要性が高まります。腫瘍は、がん細胞に十分な酸素を供給するために新しい血管を必要とします。このため、がん細胞は血管新生、つまり新しい血管を形成する能力を獲得します。がん細胞は、「angiogenic switch」を活性化するシグナル伝達分子を放出することで、新しい血管系の生成を調整します。スイッチを利用することで、腫瘍内に存在する非がん細胞が刺激され、血管が形成されます。
10. 浸潤と転移の活性化
隣接する組織に浸潤する能力は、腫瘍が良性か悪性かを決定するものであり、がんを致命的な脅威にします。転移により、がんは体中に拡散し、治療が大幅に複雑になります。がん細胞は、転移する能力を獲得するために、多くの変化を経る必要があります。転移カスケードは、局所的な腫瘍細胞の浸潤、血管への浸潤、それに続く循環系からのがん細胞の流出、新しい組織での定着を含む多段階のプロセスを示しています。がん細胞の拡散が成功する最も初期の段階において、原発がんは、腫瘍間質のクロストークを伴う腫瘍の二次的な定着部位に適応します。
11. 表現型の可塑性の解明
器官形成中に起こる膨大な分化と発達に比べ、哺乳類の細胞は通常、分化能力が限られているため、それぞれの組織内で組織化され機能し続けることができます。しかし、がんでは、細胞は分子および表現型の変化を受け、表現型スペクトルに沿って異なるアイデンティティを獲得することができます。これは、細胞の可塑性として知られています。上皮間葉転換 (EMT) と間葉上皮転換 (MET) は、分化転換に似た発達調節プログラムの例です。細胞表現型の変化は、腫瘍の発生や転移、免疫浸潤、化学療法耐性、腫瘍進行におけるその他の多くの側面を促進するため、がんの進行にとって極めて重要です。
12. ゲノムの不安定性と変異
ゲノムの不安定性、すなわち可変性は、がん細胞に遺伝子変異をもたらし、腫瘍の進行を促します。特定の変異遺伝子型は、細胞のサブクローンに選択的優位性を与え、それらが拡散して最終的に局所組織環境で優位に立つことを可能にします。哺乳類のゲノム修復機構は、DNA の欠陥を検出して解決し、各細胞の世代における自然変異率が低いことを保証しています。腫瘍形成を調整するために必要な変異遺伝子の数を増やすために、がん細胞は変異率を高めようとします。変異原性物質に対する感受性が高まることと、いくつかの構成要素におけるゲノム維持機構の破壊が、変異性を高める主な要因です。DNA 維持機構(ゲノムの「管理人」と呼ばれることが多い)の欠陥は、ヒトのがんの発症と正の相関関係にあります。いわゆる「ゲノムの守護者」であるp53は、テロメラーゼとともにこの機構において中心的な役割を果たします。
13. 非突然変異性エピジェネティックなリプログラミング
がんの特徴を大局的に見ると、「非突然変異性エピジェネティックなリプログラミング」は新たな特徴として見られています。これは、遺伝子発現における純粋にエピジェネティックに調節された変化を伴う、ゲノムリプログラミングの別の(一見独立した)様式です。エピジェネティックな変化は、遺伝子やヒストンの修飾、クロマチン構造の変化、および正と負のフィードバックループによって長期間安定して維持される遺伝子の発現スイッチのトリガーとして要約することができます。これらは、発達中の細胞と成熟細胞における遺伝子発現を調節します。類似のエピジェネティックな変化が、腫瘍の発生と悪性進行の際の特徴的な能力の獲得に寄与するという命題を支持するエビデンスが増えています。 非突然変異性エピジェネティックなリプログラミングは、前述した表現型の可塑性の特徴的な能力を可能にする鍵となっています。エピジェネティックなリプログラミングの結果、悪性 TME に生息するがん細胞の特徴である動的なトランスクリプトームの異質性が生まれます。EMT のマスターレギュレーターである ZEB1 は、非突然変異性エピジェネティックなリプログラミングの良い例です。これはヒストンメチル化酵素である SETD1B の発現を誘導し、次にこれが ZEB1 の発現を正のフィードバックループで維持し、(浸潤性の) EMT 制御状態を維持します。同様に、クロマチンランドスケープの変化による転写因子 SNAIL1 のアップレギュレーションは、EMT の構築を誘導します。変化の原因となるクロマチン修飾が、表現型の維持に必要であることは明らかです。
14. 多形性マイクロバイオーム
研究が進むにつれ、常在細菌や真菌によって作り出される生態系、つまりマイクロバイオームが健康と病気に大きな影響を及ぼすというエビデンスがますます増えています。腸内マイクロバイオームはこの新しい分野の先駆者であり、複数の組織や臓器が、微生物種や亜種の個体群動態や多様性において特徴を持つマイクロバイオームと関連しています。がんに関しては、集団内の個体間のマイクロバイオームの多型変異ががんの表現型に影響を与えるという強力なエビデンスが増えています。微生物、主に細菌(ただし、細菌だけではない)は、直接発がん性がある可能性があります。また、微生物は宿主の免疫応答に影響を与えて悪性腫瘍を促進し、抗がん療法の有効性を決定する重要なエフェクターである可能性があります。マイクロバイオームの操作は、がんの結果に影響を与える機会として有望です。
酪酸産生細菌は、腫瘍形成を促進する特定の細菌種の一例です。研究によると、酪酸産生細菌を保有する大腸がんのマウスモデルおよび患者は、そのような細菌を保有しないマウスよりも多くの腫瘍が発生しました。代謝産物である酪酸の産生は、老化した上皮細胞および線維芽細胞を誘導するなど、複雑な生理学的影響を及ぼします。
- Hanahan, D., & Weinberg, R. A. (2000). The hallmarks of cancer. Cell, 100(1), 57-70.
- Hanahan, D., & Weinberg, R. A. (2011). Hallmarks of cancer: the next generation. Cell, 144(5), 646-674.
- Hanahan D. (2022). Hallmarks of Cancer: New Dimensions. Cancer discovery, 12(1), 31-46.
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する