- ホーム
- 心筋細胞のPKCδ、PKCε両遺伝子欠失により、発生性および応答性心臓増殖抑制におけるそれらの中心的役割が明らかに
心筋細胞のPKCδ、PKCε両遺伝子欠失により、発生性および応答性心臓増殖抑制におけるそれらの中心的役割が明らかに
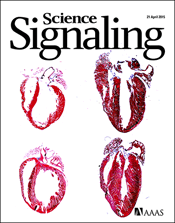
Combined cardiomyocyte PKCδ and PKCε gene deletion uncovers their central role in restraining developmental and reactive heart growth

Sci. Signal., 21 April 2015
Vol. 8, Issue 373, p. ra39
DOI: 10.1126/scisignal.aaa1855
Moshi Song*, Scot J. Matkovich*, Yan Zhang, Daniel J. Hammer, and Gerald W. Dorn II†
Center for Pharmacogenomics and Division of Cardiology, Department of Internal Medicine, Washington University School of Medicine, St. Louis, MO 63110, USA.
† Corresponding author. E-mail: gdorn@dom.wustl.edu
* These authors contributed equally to this work.
要約 細胞増殖は、発生および環境信号に反応して生じる遺伝子発現の変化によって調整されている。増殖を指示するシグナル伝達の一つは、タンパク質キナーゼC(PKC)ファミリー酵素である。これらの酵素は、在来型PKC、新型PKCおよび非典型PKCの3つのサブクラスに属するユビキタスなタンパク質である。異なるPKCアイソフォーム間で機能的重複があるため、各アイソフォームの生理作用を特定することは困難である。われわれは、2つの新型PKCアイソフォームPKCδおよびPKCεが、ストレス活性化タンパク質キナーゼおよびペリオスチンシグナル伝達の中心となる心臓遺伝子の発現を調節することにより、ストレス応答性および発生性の心臓増殖を重複して制御することを明らかにした。生後心筋細胞に特異的なPKCδ遺伝子除去およびPKCε生殖細胞系列欠失を併せ持つマウス(DCKO)の心臓は、大きさは正常であるが、病的肥大に典型的な転写の変化がみられる。血行力学的負荷によって誘発された心肥大および機能不全は、PKCδまたはPKCεのいずれかのみが欠失したマウスと比べてDCKOマウスの方が顕著であった。さらに、DCKOマウスの心臓の遺伝子発現解析の結果、キナーゼERK(細胞外シグナル調節キナーゼ)およびペリオスチンをコードする遺伝子の転写抑制解除が認められた。胚のPKCδおよびPKCεを除去したマウスでは、増殖亢進および心筋細胞過形成がみられ、その結果、病的心室硬化および早期致死が誘発された。これは、PKCδまたはPKCεのいずれかのみが欠失したマウスにはみられない表現型であった。本研究の結果から、新型PKCは、発生およびストレス適応の中心となる増殖シグナル伝達経路に対し、逆行フィードバック阻害作用を示すことが明らかになった。このような新型PKCの増殖抑制作用が、がん、心臓病およびその他の疾患におけるPKCによる治療的阻害に関与している。
M. Song, S. J. Matkovich, Y. Zhang, D. J. Hammer, and G. W. Dorn, Combined cardiomyocyte PKCδ and PKCε gene deletion uncovers their central role in restraining developmental and reactive heart growth. Sci. Signal. 8, ra39 (2015).
2015年4月21日号