Proteintech(PGI)社商品 FAQ・トラブルシューティング
Proteintech(PGI)社商品 FAQ・トラブルシューティング
 商品詳細 「プロテインテック(Proteintech)社抗体のご紹介」
商品詳細 「プロテインテック(Proteintech)社抗体のご紹介」
本プロトコールの全てのステップは、特に記載がない限り、室温で実施してください。
■ SDS-PAGE
1. SDS-PAGEゲルをターゲットタンパク質の分子量(MW)に応じて構成します(推奨のゲル処方は下記参照)。
Top tip 1:
トリス-トリシンゲルは、トリス-グリシンゲルより低い分子量のタンパク質(<20kDa)を分離します。
Top tip 2:
濃度勾配ポリアクリルアミドゲルは、シャープなバンドが得られ、1つのゲル上で広範囲の分子量サイズ(10-500kDa)を分離できます。
2. サンプルをマイクロチューブに準備します。1サンプル当たりのトータルタンパク質量が30-50μgになるように、4X SDSサンプルバッファーを加えます(タンパク質量は、Bradford又はBCAタンパク質アッセイで測定してください)。
3. マイクロチューブを軽くはじいて混合し、95-100℃で5分間加熱します。
4. 電気泳動装置をセットアップし、1×泳動バッファーに浸します。ゲルのくしを取り除き、濃縮ゲルのウェルを洗浄します。
5. サンプル及びタンパク質マーカーを、ローディングチップを使ってゲルにロードします。電気泳動パワーパックを80V(濃縮ゲル全体)にセットし、泳動タンパク質の先端が分離ゲルに達したら120Vに上げます。
Top tip 3:
最初の実験ではサンプル量を多くし、ターゲットシグナルを確認したあと、適宜調節してください。
■ タンパク質転写
6. PVDF膜(又はターゲットの分子量が30kDa未満の場合は、微小孔が0.22μmのPSQ膜)を推奨します。膜をメタノールに30秒間浸し、転移バッファーに移します。ろ紙及びスポンジも同様に転移バッファーに移します。
7. 下図に従って順番にスポンジ、ろ紙、ゲル、膜を、気泡が入らないように、重ねます。メーカーの取り扱い説明書に従って、セミドライ転写システム又はウェット転写システムにかけます。
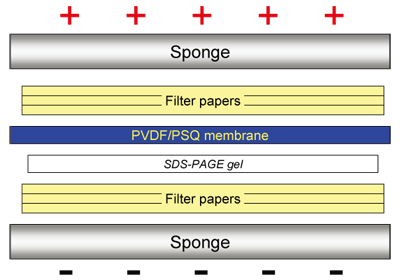
図1 転写「サンドイッチ」の構成図
ゲルと膜の方向が非常に重要です。PVDF膜がプラス電極に近い方になるようにセットしてください。アミノ酸は負に荷電しており、タンパク質はプラス極に向かって移動します。
Top tip 4:
ターゲットの分子量が100kDaより高い場合、セミドライ転写システムの代わりにウェット転写システムを4℃でオーバーナイト使用することを提案します。更に、ウェット転写バッファーに0.1% SDSを添加することで、転写しやすくなります。
Top tip 5:
2mLのstripetteを「めん棒」としてとして使用し、「サンドイッチ」上を回転させることで、生じてしまった気泡を除去することができます。
■ イムノブロッティング
8. 転写後膜を蒸留水で2回洗浄し、膜に鉛筆でMWラダーのバンドの印をつけます。必要な場合は、膜を市販のPonceau red溶液で1分間染色し、タンパク質のバンドを可視化します(その後大量の1X TBSTでPonceau red染色を洗い流してください)。
9. 脱脂粉乳(2-5%)(又は、リン酸化エピトープ抗体の検出の場合は、1-5%BSA)を含む1X TBSTでブロッキングし、4℃で1時間又はオーバーナイト一定に揺らしながらインキュベートします。
10. 一次抗体をブロッキング溶液で希釈します(1:1000倍希釈からスタートし、最適な希釈倍数を予備実験で決定してください)。膜を、ベンチトップのローター上で、一次抗体と4℃で1時間又はオーバーナイトインキュベートします。
11. 膜を1X TBSTで3回(各10分間)洗浄します。
12. 膜を対応するHRP標識二次抗体(一次抗体の免疫動物種を認識する抗体)とインキュベートします(二次抗体はブロッキング溶液で1:5000-1:50000の範囲で希釈してください)。一定に揺らしながら1時間インキュベートします。
13. 膜を1X TBSTで3回(各10分間)洗浄します。
Top tip 5:
ブロッティングの工程では膜を乾燥させないでください。
Top tip 6:
一次抗体溶液の長時間インキュベートには、抗体希釈バッファーに0.2% NaN3を添加することができます。
ご注意:二次抗体溶液には適用できません。