得られたタンパク質が目的の物質かどうかを同定するには、時にはかなりの困難を伴います。精製して得られた画分のせめて一部分のアミノ酸配列でも決定できれば、既知タンパク質のアミノ酸配列と比較して同定ができます(アミノ酸配列の決定については9章を参照)。また、精製タンパク質のプロテアーゼ消化によるペプチドマップからも同定する方法が開発されています(第8章を参照)。しかし、免疫化学的方法すなわち目的のタンパク質に対して特異的な反応を示す抗体を入手し、それを用いて同定することは非常に有効な手段である上に簡便でもあり、さらに定量目的にも用いることが出来ます。その他に複雑な混合物系で目的物だけを検出することが可能で、たとえば経口的に摂取したラクトフェリンが消化管内でどのように分解されているのかを追跡するためには、抗体を用いた分析は有効な手段となります。
上記の目的のために、ラクトフェリンを抗原(antigen)とし、それに対する抗体を得るためにウサギ、マウス、ウマ、ヤギ、ニワトリ、モルモットなどに免疫し、体内で抗体(antibody)を産生させます。その際、抗体産生を促すためにフローイントアジュバント(Freund adjuvant)などの免疫補助剤を用います。数回の免疫後、採血をして血清中に含まれる抗体の力価を測定します。免疫に用いる動物および必要量によって採血方法は変わります。たとえばマウスでは眼窩静脈から毛細管を用いて採血します。ウサギでは耳静脈から、あるいは心臓穿刺によって採血します。十分に抗体価があがったら全放血させ、血液を静置して血清と血餅に分離します。抗体を含む血清すなわち抗血清は、アジ化ナトリウムなどの保存剤を入れて小分けし、使用時まで低温で保存します。
上記のようにして得られた抗血清はポリクローナル抗体を含み、そのまま各種の免疫化学的実験に用いることができますが、目的によっては血清中に含まれる抗体すなわち免疫グロブリン(immunoglobulin, Ig)を精製して用います。抗体の精製にはProtein AやProtein Gによるアフィニティークロマトグラフィーが多用されますが、塩析法やイオン交換クロマトグラフィー法でも分離でき、量や目的によって使い分けます。
抗血清(ポリクローナル抗体)を作成しても、目的物以外の物質に対する抗体が生成する場合があります。これは、免疫に用いた抗原に不純物として含まれていた物質に対する抗体も出来るためです。これを除くには、本当に純粋な抗原物質で固定化カラムを作成して、吸着する抗体成分だけを分取します。あるいは不純物として含まれている物質が明らかなときは、その不純物を固定化したカラムを作成し、そのカラムを通過する成分だけを用います。これはアフィニティークロマトグラフィーの一種です。不溶性の抗原抗体複合体を形成する場合には、遠心分離操作で取除くことも可能です(第4章参照)。
抗体価(力価)の測定には、以前は二重拡散法(Ouchterlony法)が用いられていましたが、最近はもっぱらELISA法 (enzyme-linked immunosorbent assay)が用いられるようになりました。ELISA法については次章に説明がありますので、古典的なOuchterlony法を説明します。ガラス板あるいはプラスチック枠に流し込んで固めた、厚さ1-1.5 mmの寒天(agar)またはアガロース(agarose)に、抗原を入れる穴とそれを囲んで希釈抗血清を入れる穴(通常は6個)を5-10 mm間隔で作ります。穴の直径は2 mm程度です。抗原と抗血清がそれぞれゲル内で拡散し、出会って生じた沈降線の位置を観察します。希釈率の高い抗血清で沈降線が生じるほど、抗体価が高いこととなります。
抗原分子が大きい場合には、抗体が認識する抗原分子上の部位が複数あるのが一般的です。それらの部位の内、特定部分だけを特異的に認識する抗体がモノクローナル抗体(monoclonal antibody) です。その調製法は図3-1に示したようにマウス腹腔内にアジュバントと混合した抗原を注射し、十分に抗体価が上がった時に脾臓を摘出し、そこから得たB細胞とミエローマ細胞とで融合細胞(ハイブリドーマ)を作成します。次いで融合細胞の培養、抗体産生細胞のスクリーニング、クローニングを行ない、目的抗体を産生する融合細胞だけを培養フラスコ中で増殖させ、培養液上清中に分泌された抗体を得ます。
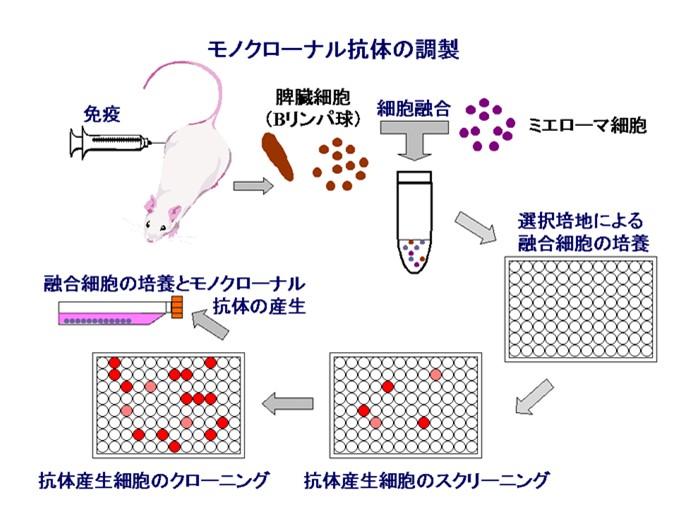
図3−1.モノクローナル抗体の調製方法
産生された抗体のクラス、サブクラスを判定するためには、それぞれのクラスあるいはサブクラスに特異的に反応する抗体を用います。なお、このようにして得られた抗体が認識する抗原分子内の部位、すなわち抗体結合部位を抗原決定基(antigenic determinant) あるいはエピトープ(epitope)といいます。
商品紹介:ラクトフェリン モノクローナル抗体 |
 略号:HCB 略号:HCB |
| 品名 | メーカー | 品番 | 包装 |
|---|---|---|---|
|
Anti Lactoferricin B, Bovine (Mouse) Unlabeled, 5F12.1.2 |
HCB | HM4012 | 100 UG |
|
Anti Lactoferrin (C-lobe), Bovine (Mouse) Unlabeled, a-bC-lobe |
HCB | HM4013 | 100 UG |
ラクトフェリンは一本鎖ペプチドからなるタンパク質ですが、2つのローブ(lobe)から構成されています。N末端アミノ酸残基を有する側をNローブ(N-lobe)、C末端側をCローブ(C-lobe)といいます。各ローブに対して特異的なモノクローナル抗体を得るために、Nローブの一部であるラクトフェリシンと、Cローブをそれぞれ用いてマウスの免疫を行ないました。ラクトフェリシンを免疫する場合は担体としてのタンパク質keyhole limpet hemocyanin (KLH)を架橋試薬1-ethyl- 3-(3-dimethylamino propyl) carbodiimide/ HClを用いてカップリングさせて用いました。担体としてはその他に血清アルブミンや特殊な合成ペプチドも用いられます。
なお、タンパク質のアミノ酸配列が既知である場合に、その一部のアミノ酸配列を持つペプチドを合成して抗原として用い、抗体を作る場合があります1)。たとえば目的とするタンパク質を精製することが非常に困難な場合などです。そのような場合にはまずC末端領域を抗原とすることが推奨されています。N末端を含む部位を抗原とするには、末端やあるいはその近辺に何らかの修飾を受けて(ブロックされて)いる部位が無く、また疎水性でないことが必要であることなどが、経験的に知られています。両末端部位がふさわしくない場合、中間の配列について、hydrophobicity, surface probability, antigenicity index(第12章を参照)などを参考にして検索します。また、βターン領域は分子の外側を向いていることが多いということで、抗原として用いるのにふさわしいと考えられています。
| 種 | 種類 |
|---|---|
| ヒト | IgG (IgG1, IgG2, IgG3, IgG4), IgD, IgE, IgA, sIgA, IgM |
| ウシ | IgG (IgG1, IgG2), IgA, sIgA, IgM |
これまで抗体について述べましたが、抗体として機能している分子は免疫グロブリンです。自由界面型電気泳動法 (Tiselius電気泳動)で分析した場合にγ領域の分離ピークが該当したことから、γグロブリンともよばれていました。免疫グロブリンにはさまざまなクラス、サブクラスがあり(表3-1)、それぞれの抗原性によって識別されました。また、およその分子量がそれぞれ50 kDa(約500残基) のH鎖と25 kDa(約215残基)のL鎖それぞれ2本づつから構成され、各鎖はジスルフィドで結合しています。その分子モデルを図3-2に示しました。
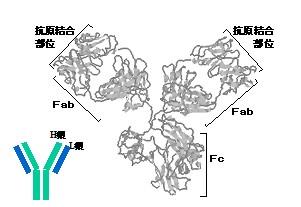
図3-2. 免疫グロブリン(IgG)の分子モデル (1IGY.pdb)

























