抗原抗体反応では抗原と抗体の比が当量点の範囲にある場合、生じた複合体が凝集して最終的に不溶物が形成され(沈降反応)、可視的な観察が可能です。たとえば試験管による一次元の沈降反応(Oudin法)や、寒天ゲルを用いた二次元の沈降反応(Ouchterlony法)、あるいは抗体(抗血清)含有寒天を用いた沈降反応や、免疫電気泳動(immunoelectrophoresis)などです。また抗原を定量する方法として、一元平板免疫拡散法(single radial immunodiffusionまたはMancini法)、免疫電気拡散法(immunoelectro diffusionまたはロケット法)、交差免疫電気泳動法(crossed immunoelectrophoresis)などがあります。
免疫電気泳動は、混在する成分が多い場合の解析に適した方法ですが、抗血清を比較的多く(〜100µL)消費します。しかし抗血清や抗体を用いた凝集反応は、たとえばラテックス凝集反応など、非常に鋭敏に抗原を検出する方法として使用されているものもあります。なお、抗原に抗体が結合しても、可溶性の複合体しか形成されず凝集が認められない場合には、ラジオイムノアッセイを組み合わせるなどの工夫をしなければなりません。
夾雑物が存在している場合でも、抗体は特定の抗原と特異的に反応し複合体を形成するため、これを利用して目的物質を分離することができます。形成された複合体が不溶性の場合は、遠心分離操作で沈殿物を分離した後に、抗原と抗体を解離させて混合物中から目的物、すなわち抗体に結合性を示す物質を単離する方法があり、免疫沈降法(immunoprecipitation)と呼ばれます。また、沈降性の複合体を生成しない場合でも、さまざまな担体表面に抗体を固定化し、分離だけではなく分析にも応用されています。たとえば抗体を担体に固定化し、これを用いたアフィニティークロマトグラフィーは汎用されています。一般には中性のpHで低イオン強度の緩衝液を用いると抗原抗体複合体が形成され、0.1 M 酢酸溶液などで解離させて溶出します。
ELISA(enzyme-linked immunosorbent assay)法は抗体と反応する物質を検出する非常に鋭敏な方法の一つで、また定量にも威力を発揮します。96穴のプラスチック製プレート(マイクロプレート)を反応容器として用います。各穴に抗原を含む試料を吸着させ、次いで抗体(一次抗体という)を抗原に結合させて、結合した抗体量を測定して抗原量を推定する方法です。目的の抗原に特異的に結合した抗体を検出・定量するために、酵素標識した抗免疫グロブリン抗体(二次抗体という)を用います。二次抗体としては、一次抗体を作成した動物とは異なる動物を用いて免疫して得られた抗体を用います。
上記の標識酵素としては西洋ワサビペルオキシダーゼ(horseradish peroxidase)、アルカリフォスファターゼ(alkaline phosphatase)、βガラクトシダーゼ(β-galactosidase)などと、それらの酵素反応によって呈色する色素が基質として用いられます(表4-1参照)。反応後の発色の度合いは、ELISAプレート読取り専用の分光器(マイクロプレートリーダー)を用いて定量します。なお、検体中の抗原を検出あるいは定量するには、まず目的物質に対する抗体をマイクロプレート穴に吸着させ、次いで試料を添加して含まれる抗原だけを抗体に結合した形で保持させた後に、上述の一次抗体、二次抗体を反応させて定量するサンドイッチ法(sandwich ELISAまたはdouble antibody ELISA)が主に用いられます。
SDS-電気泳動を行った後、泳動ゲル内のタンパク質をニトロセルロース膜やPVDF膜などへ転写し、以降の操作で妨害とならないタンパク質(ゼラチンやその加水分解物、あるいは血清アルブミンなど)で膜上の残存反応基に対してブロック操作をした後、抗ラクトフェリン抗体を反応させます。次いで酵素標識二次抗体を用いて膜上のラクトフェリンの検出を行ないます。このように電気泳動後のゲルを膜に転写して免疫化学的な方法で検出することをウエスタンブロット(Western blot)といいます。また、転写のためにはもっぱらセミドライ型の転写装置で膜側を陽極にゲル側を陰極にして通電する方法が用いられます。酵素免疫法による検出感度は、たとえばペルオキシダーゼ・ジアミノベンジジン・過酸化水素を用いる系では1バンド当り500 pg程度ですが、ケミルミネッセンス法 (chemiluminescence)では1バンド当り10 pg以下といわれます。
あるタンパク質がどの部位の組織に存在しているかを観察するためにも、抗体が用いられます。ラクトフェリンで行った一例を述べます。まず対象とする組織の切片を作製し、内因性ペルオキシダーゼの影響を取り除くため、0.3% 過酸化水素/メタノールで処理します。次いでヤギ正常血清、ウサギ抗ウシラクトフェリン抗体、ヤギ抗ウサギIgG抗体の順で反応させます。最後にペルオキシダーゼとウサギ抗ペルオキシダーゼ抗体との複合体を作り、これを反応させます。過酸化水素を含むDAB溶液(表4-1を参照)を用いて発色させ、ラクトフェリンが乳腺細胞で発現していることが観察されました1)。なお、この方法をPAP (peroxidase-antiperoxidase)法といいます(図4-1)。
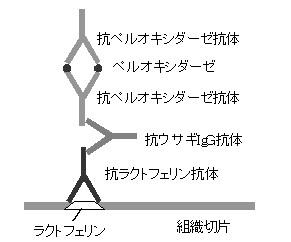
図4-1.PAP法の原理。抗ラクトフェリン抗体と抗ペルオキシダーゼ抗体はウサギで作製。最終的に、ペルオキシダーゼの基質を加えて不溶性の反応物を生成させる。