ミルク(牛乳)を摂取した場合、胃の中で胃酸によってカードとホエイとに分離され、ホエイ成分はそのまま胃を通過して腸へと移行し、凝固したカゼイン成分(カード)はペプシンによる分解で断片化されます。小腸では主に栄養素と水分の吸収が、大腸ではもっぱら水分の吸収が行われます。小腸の内腔側の壁には突起状の絨毛(じゅうもう)が覆っており、それを構成しているのが上皮細胞です(図7-2)。各上皮細胞同士は密着結合しており、また短期間で新陳代謝しています。各細胞の内腔側を頂端部、その逆側を基底部といい、細胞外マトリクスで構成された基底層によって結合組織に連なっています。栄養物を取り込むのが吸収細胞で、頂端部に多数の微絨毛を持っているために刷子縁細胞といいます。粘液を分泌する杯細胞も存在しています。さらに腸上皮には各種のレセプターも存在し、ラクトフェリンレセプター1)も見い出されています。
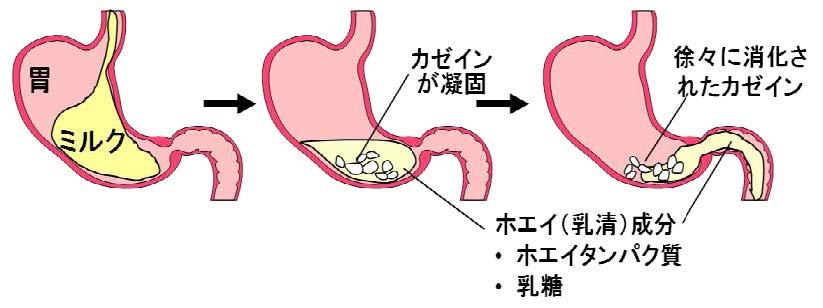
図7-1 経口で摂取されたミルクの胃内での挙動
赤ん坊が母乳を摂取した場合ではやや異なるので注意。
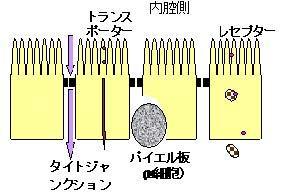
図7-2消化管と小腸粘膜上皮細胞の構造
ここに描いた上皮細胞層は、粘膜層によって覆われている。
消化管免疫2)
小腸や大腸は食物の消化吸収だけではなく、経口的に摂取されたさまざまな異物に対して身体を守る役割も持っています。腸管の表面は粘膜層で覆われており、その主成分は高分子量の糖タンパク質であるムチン(mucin)です。異物として病原体などが消化管に取り込まれた場合、このムチンがまず物理的なバリアーとなり、さらにその他の抗菌性物質も働き、これらは非特異的な防御作用となります。そこを突破して病原性の微生物が上皮細胞層に達しても、上皮細胞に挟まれてTリンパ球群が存在しており、さらに分泌型IgA (sIgA)が多量に存在して上皮細胞への付着を阻止しています。この分泌型IgAは二量体の免疫グロブリンです。ラクトフェリンを経口摂取することで、唾液や糞便中のsIgA濃度が増加を観察した報告があります3)。
経口的に摂取された物質が自身にとって異物、すなわち抗原と認識されて免疫システムによる防御反応が発動されるためには、腸管関連リンパ組織(GALT)であるパイエル板とそのドーム状の上皮細胞層に存在するM細胞が大きな役割を担っています。単純化すると、M細胞が抗原取り込みを行い、その下方(濾胞域)に存在している抗原提示細胞(大食細胞や樹状細胞など)に渡します。これらの免疫担当細胞内において抗原は修飾を受け、Tリンパ球やBリンパ球に抗原特異的な活性化を促します。腸管とは限らず、粘膜を有する組織における免疫関連リンパ組織で誘導された抗原特異的リンパ球は、リンパ液や血液の流れに乗って全身を巡ります。その後、大腸、小腸、気管支、唾液腺、涙腺、乳腺などのリンパ組織に到達して分泌型IgAを産生するようになります。腸管などの粘膜組織から出て再び粘膜組織に戻るため、これをホーミングといいます。また、腸管から乳腺に渡る経路を腸管乳腺経路といい、母乳によって育つ乳児の健康に非常に重要な働きをしています(図7-3)。
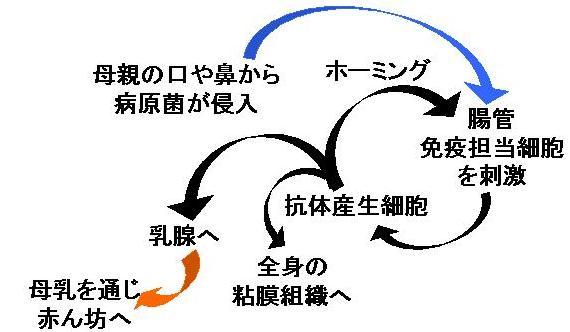
図7-3. ホーミングと腸管乳腺経路
青い矢印は体外からの異物の侵入を、赤い矢印はミルクを表す。抗原感作を受けたIgAを産生するBリンパ球の前駆細胞が黒矢印で示したように循環する。
ラクトフェリンの消化管内での作用
ラクトフェリンの腸内菌叢に対する効果として、病原性細菌の抑制作用や第6章で示したビフィズス菌の生育促進などの他に、バクテリアルトランスロケーションを抑制する作用4)も報告されています。これらラクトフェリンが微生物に対して示す効果の他に、動物実験ではラクトフェリンが腸管上皮細胞に作用してインターロイキン18 (IL-18)を産生させたり5)、NK細胞を活性化する6)ことも見いだされています。IL-18はINF-γ誘導因子として知られている物質で、細胞性免疫および液性免疫に密接に関連する機能が見出されており、抗腫瘍活性などラクトフェリンの示す機能のいくつかを説明できる可能性があります。
経口摂取による機能の発現
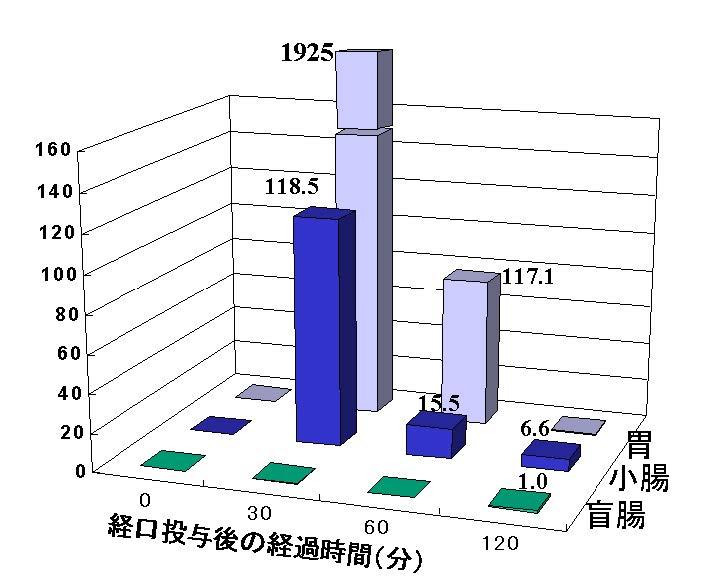
ラクトフェリンを経口摂取すると、消化酵素の働きによって各種フラグメントが生じ、ラクトフェリシンのような活性ペプチドの生成も期待されます。ラットにラクトフェリンを投与した場合の、胃、小腸、盲腸内での残存ラクトフェリン量を測定した例7)を図7-4に示します。一方で鉄飽和型(ホロ型)ラクトフェリンの方が不飽和型(アポ型)よりもタンパク質分解酵素に対して抵抗性があることが観察されています。このことは、ラクトフェリンが胃内においても鉄を保持したまま、次の段階へと移行することができることを示唆しています。乳児あるいは仔牛が鉄分を吸収するに当たり、ラクトフェリンが腸内で有効に働いているとの考えが提唱されている反面、無機鉄とラクトフェリン結合鉄の吸収に差は無いとする否定的な実験結果もあります。腸管のラクトフェリンレセプターに関する報告では、ラクトフェリンが鉄吸収の調節に関与している可能性を示唆しています8)が、ラクトフェリンを発現しないノックアウトマウスを用いた実験では、腸内の鉄ホメオスタシスの制御にラクトフェリンは重要ではなく、貧血には寄与していないとの結果が報告されています9)。しかし最近、特に女性の貧血にラクトフェリン鉄が有効との報告もあります10)。
消化管から血中へ
ラクトフェリン錠剤を摂取した場合に、消化管以外の部位においてラクトフェリン摂取効果が数多く報告されています。血中C型肝炎ウイルス濃度が減少したり11)、足白癬(水虫)に効く12)などはその代表例です。経口的に摂取されたラクトフェリンが、消化管以外で働くには、腸管から腸壁を通過して血液中に移行しなければなりません。これは未熟児に投与された母乳由来のラクトフェリンがその児の尿中に検出されたことから証明されています13)。母親に同位体標識した必須アミノ酸を投与し、乳腺で標識ラクトフェリンが合成・分泌された母乳を赤ん坊に摂取させ、追跡調査したものです。しかし、乳児以外での吸収過程については不明で、今現在もホットな研究課題です。
ブタを用いた経口投与実験では、ウシラクトフェリンが腸上皮細胞から吸収され、次いで胆汁中に排泄されて再度腸上皮細胞から吸収される腸肝循環を行っていること、さらに脳脊髄液へも移行するとの報告14)があります。このような体内での輸送過程においては、ラクトフェリンレセプターやリンパ系が大きな役割りを果たしているとのことです。なお仔ブタの場合、血中へ移行するラクトフェリンは投与量の10-3程度ではないかと推察されています。ヒトやラットでの経口投与実験では、血中への移行量を測定してもはっきりした値を得ることはかなり困難ですが、それは血中に移行する量がELISA法の検出限界ギリギリのためかもしれません。