細胞や組織に存在するさまざまなタンパク質が他の物質と結合することは、それらが生体において機能を発現するために必然的な挙動です。しかし、ラクトフェリンが関与する相互作用が生体においてどのような役割りを果たしているのかという点については、解明された例はまだ僅かしかありません。
相互作用の意義を解明することもさることながら、これら分子間の結合および解離などの相互作用を応用すると、目的タンパク質を分離したり、あるいは逆にそのタンパク質と結合する物質を分離するための有効な手段となり得ます。ラクトフェリンの場合は、ヘパリンカラムを用いたアフィニティー(親和性)クロマトグラフィーがよく用いられますが、その他に一本鎖の(single strand) DNA、あるいはβラクトグロブリンを担体に固定化してアフィニティークロマトグラフィーを行い、ラクトフェリンを分離した例もあります。
ヘパリンとの結合
ラクトフェリンがヘパリンと結合することは良く知られています。ヘパリンカラムに結合したラクトフェリンは濃度が8Mの尿素を加えても離脱せず、NaClなどでイオン強度を上げることによって初めて解離し、カラムから溶出します1)。
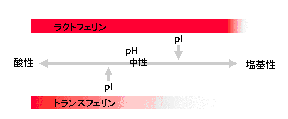
トランスフェリンファミリータンパク質の代表であるトランスフェリンもラクトフェリンと同様にヘパリンへの結合性を示します。しかし、両者のヘパリン結合のpH依存性は大きく異なります。固定化ヘパリンカラムへ結合するpHの範囲がラクトフェリンの場合は非常に広くなっています。図3-1に示したように、ラクトフェリンでは等電点(pI)を超えたpHにおいてもヘパリンに結合することを示しています。ヘパリンは硫酸基を持つ多糖です。他方、ラクトフェリンは等電点が弱塩基性のタンパク質で、トランスフェリンは等電点が弱酸性側にあります。この電気的な性質の違いが図3-1をある程度説明できます。しかしこれだけではラクトフェリンとヘパリンの結合は単なるイオン結合で非特異的な結合であると考えることもできます。
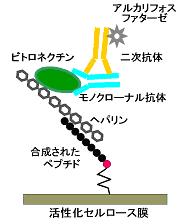
そこでラクトフェリン分子内でヘパリン結合性に特異的に関与している部位があるかどうかを調べる実験を行いました。そのために、構造編で述べた抗体結合部位を決定した方法が役に立ちました。まず、ウシラクトフェリンのフラグメント化を行い、ヘパリン結合性を保っているフラグメントを固定化ヘパリンカラムを用いたアフィニティークロマトグラフィーによって分離しました。このフラグメントのアミノ酸配列を決定し、さらにSPOTsによるペプチドの化学合成(構造編第10章参照)を行ってヘパリン結合性を示すアミノ酸配列を決定しました。その場合、抗ヘパリン抗体が入手できないので、ヘパリン結合タンパク質の一つであるビトロネクチンを用い、さらに抗ビトロネクチンモノクローナル抗体とアルカリフォスファターゼ標識した二次抗体を用いて検出しました(図3-2)。その結果、ウシラクトフェリンではNローブに存在する配列のKCRR (18-21)とRMKK (25-28)がヘパリンとの結合に特異的なアミノ酸配列であることが分かりました。塩基性側鎖を持つアミノ酸をBで表すと、BXBBという配列となります。同様に、BXBBに相当するアミノ酸配列はCローブにも存在しますが、ヘパリン結合性は認められませんでした。なお、他のヘパリン結合性タンパク質では、BBXB、BBBXXB、BXXBBXBなどがヘパリン結合部位として知られています 2)。
リガンド結合による構造変化
ラクトフェリンが鉄イオンと結合することによって構造変化が生じることは前章で述べましたが、その他の構造変化の例も観察されています。上述した方法で得られたウシラクトフェリンのヘパリン結合部位は、ラクトフェリシン(機能編第5章を参照)と呼ばれる部位の一部でした。そこでラクトフェリシンとヘパリンの相互作用を円偏光二色性(CD)スペクトルの測定によって観察してみました。ラクトフェリン分子のX線結晶解析データによると、ラクトフェリシンに相当する部分にはαヘリックス構造が存在していることが明らかです。しかし、ラクトフェリンから分離してラクトフェリシン部分だけにすると、αヘリックス構造は消失してβ構造と不規則構造とになっていることが分かりました(表3-1 A)。ラクトフェリシンにαヘリックス構造がないことは、NMRによる構造解析からも確かめられます(図3-3)。さらにヘパリンをラクトフェリシン溶液に加えると両者が相互作用し、その結果として、構造の変化が生じてαヘリックスとβ構造が増加し、不規則構造が減少しました(表3-1 A+B)。この溶液に1 M NaClを加えてヘパリン-ラクトフェリシン複合体が解離する条件にすると、再びαヘリックス構造は消滅し、不規則構造が増加しました(表3-1 A+B+C)。
| へリックス | β構造 | βターン | 不規則 | |
|---|---|---|---|---|
| A | 0% | 35-45% | 10-15% | 50% |
| A + B | 5-10 | 45-50 | 10-16 | 30-35 |
| A + C | 0 | 35 | 15 | 50 |
| A+B+C | 0 | 20 | 35 | 45 |
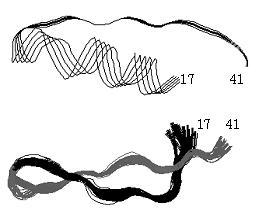
図3-3.ウシラクトフェリシンの立体構造の変化。
上図はラクトフェリン分子中の25残基(17-41)部分の立体構造(1blf.pdb)3)で、X線結晶構造解析によって求められたもの。下図は遊離のラクトフェリシン分子の立体構造で、NMR解析による結果(1lfc.pdb)4)。いずれも主鎖だけを示す。図中の数値はアミノ酸残基番号。
タンパク質との相互作用
ラクトフェリンは他のミルクタンパク質であるβ-ラクトグロブリンやカゼインにも結合します。牛乳から得られるカゼインには様々ありますが、主なものはαs-、β-、κ-カゼインです。そこで、どのカゼイン成分に最もラクトフェリンが結合し易いかを調べてみました。臭化シアンで活性化したセファローズCL4Bを用いて3種のカゼインをそれぞれ固定化し、アフィニティークロマトグラフィーを行いました。具体的には、各カゼインを固定化したカラムにラクトフェリン溶液を添加し、吸着したラクトフェリンをNaClの濃度勾配を用いてカラムから溶出させます。早く溶出するほど、すなわち溶出に必要な塩濃度が低いほど結合力が弱いと考えられます。その結果、ラクトフェリンの各カゼインに対する相互作用の強さは、αs-カゼイン > β-カゼイン > κ-カゼインの順となりました。この順はカゼインのリン酸基含量の多い順と一致しています。
さらに、BiaCoreを用いて同様な実験を行ってみました。BiaCoreとは表面プラズモン共鳴(SPR)を測定原理とし、分子間の相互作用の特異性、親和性の強弱、結合・解離の速さ、濃度などの情報を得る方法で、相互作用の解析にとって非常に有効な手段と考えられています。リガンドとなる分子をセンサーチップ表面に固定し、固定化リガンドと相互作用する分子(アナライト)を反応させ、モニターします。この場合はラクトフェリンをセンサーチップに固定化し、各カゼイン溶液を流して相互作用を観察しました。その結果、確かにカゼインがラクトフェリンと結合することが確かめられましたが、その結合の順位についてはアフィニティークロマトグラフィーで得られた結果とは若干異なる結果が得られました。この結果の矛盾は恐らく、測定原理の違い、あるいは結合条件の違い、さらには何か未知の原因があるかもしれません。
その他の高分子物質との相互作用
本章の最初で述べたように、ラクトフェリンは様々な高分子物質と相互作用します。たとえば各種のタンパク質、DNA、多糖類ではリポ多糖(lipopolysaccharide)、寒天、アガロース、ヘパリンなどが主なものです。特にリポ多糖は精製ラクトフェリンにおいても完全には除去できない程の強い結合性を示します。このことはラクトフェリンのin vivoおよびin vitroでの実験結果の解釈において常にトラブルの原因となっています。なお、リポ多糖の結合部位は、ラクトフェリンのN末端側にあります5)。
ラクトフェリンはDNAとも相互作用するとの報告が、数多くみられます。細胞が増殖する、すなわち細胞分裂が起きる際に、ラクトフェリンが何らかの引き金を引くと考えるのが妥当です。たとえば、細胞周期に関連するさまざまなタンパク質の制御なども関係していると考えられています。細胞増殖ではなくとも、たとえばラクトフェリンがあるサイトカイン分泌を促進したり、あるいは阻害する場合も、DNAのプロモーター部位への結合などが考えられています。
ラクトフェリンとDNAの結合に関する初期の研究に、ヒトDNAのフラグメントからラクトフェリンと親和性の高い部分を分離し、さらに30塩基対の合成ヌクレオチドを用いて、分離とPCRによる増幅を何度も繰り返して行い、ラクトフェリンに結合する塩基配列を決定してその作用を突き止めようと試みた報告があります6)。この場合、ラクトフェリン-DNA複合体は抗ヒトラクトフェリンモノクローナル抗体を用いた免疫沈降法で分離しています。
相互作用の測定法
多くの相互作用測定法は、溶液中で測定する方法と何らかのチップ上で測定する方法とに分けられます。前者はたとえば蛍光相関分光法(FCS)、等温滴定カロリーメトリー法(ITC)、流体力学的方法(超遠心(沈降平衡)法、電気泳動法、ゲルろ過法など)、分光学的方法(紫外部あるいは可視部での吸光度変化、円偏光二色性スペクトルの変化など)、アフィニティクロマトグラフィー、電場中での分子の配向の変化を測定する方法などが相当し、後者の方法には表面プラズモン共鳴法(SPR)、水晶振動子マイクロバランス法(QCM)、などがあります。