モノクローナル抗体が抗原分子のどの部分を認識するか、すなわち抗体結合部位(epitopeまたはepitopic site) を知ることは、モノクローナル抗体の特異的な反応特性を明らかにすることであり、データの解釈だけでなく、その抗体を利用する際に大きな助けとなります。そこで、前章で調製した抗ラクトフェリンモノクローナル抗体が認識するラクトフェリン分子内の部位を決定することにしました。まずラクトフェリンをいくつかのフラグメント(断片、fragment)に分解し、抗体に対する反応性をそれぞれについて調べました。反応性を示すフラグメントはさらに小さなペプチドに分解し、反応性を保持した最小単位のペプチドを得ました。このように十分に小さなペプチドが抗原性を示す場合は、そのアミノ酸配列が抗原としての要因であることは明らかです。一方、このような方法では抗原性が消失してしまう場合があり、そのような場合の抗体結合部位、すなわち抗原決定基は立体構造依存性である可能性が大きいといえます。
ラクトフェリンは、鉄イオンを飽和している場合(ホロラクトフェリン)と、結合していない場合(アポラクトフェリン)とで、タンパク質分解酵素(プロテアーゼ)に対する感受性が異なり、ホロ型の方が分解に対して抵抗性を示します。さらに、未変性(native)な状態と変性 (denatured)した状態とでは、分解の様相が大きく異なります。このような性質を利用して分解反応を段階的に行いました。具体的には、まずホロラクトフェリンにトリプシンを作用させてNローブとCローブに大きく分ける限定分解(mild digestion)を行ない1)、次章で述べるオクタデシル(octadecyl)カラムを用いた逆相クロマトグラフィーで主要な成分を分離しました。より多くの試料を得るため、あるいは有機溶媒による変性を避けるためには、陽イオン交換クロマトグラフィーによる分離も可能です。各フラグメントについて、ジチオスライトール(DTT)または2-メルカプトエタノールを用いてジスルフィド結合を開裂させ、4-ビニルピリジン(4-vinylpyridine)を反応させてピリジルエチル化(pyridylethyla¬tion)しました。その後、これらのフラグメントを8M尿素溶液に溶解して変性させた後、尿素濃度を2Mとなるように希釈して再びトリプシンを作用させました。なお、分解に用いるトリプシンの量は基質の1/50〜1/100が一般的です。微量の酵素で行う場合には、反応時間をより長くします。このようなタンパク質分解酵素や後述する糖関連酵素は、低濃度の変性剤存在下でも活性を示すことが多いようです。また、反応終了後に加えた酵素類を分離する必要がある場合は、加熱変性させたり、適切な濃度の除タンパク剤を加えるなどして除去します。あるいは固定化酵素を用いる方法もあります。
酵素による以外に、化学的な方法でタンパク質のペプチド結合を開裂させる方法もあります。最も一般的に行われるのは臭化シアン(CNBr)を用いる方法です。この反応ではMet残基のカルボキシル側のペプチド結合が切断されます。その他、N-ブロモサクシンイミド(N-bromosuccinimide, NBS)による反応でTrp残基のカルボキシル側が切断されますが、Tyr残基とHis残基も同時に切断されることがあります。50% 酢酸中におけるBNPS-スカトールによる反応やジメチルスルホキシド(DMSO)- HCl-HBrによる反応でもTrp残基がほぼ特異的に切断されます。ヒドロキシルアミンによる反応ではAsn-Gly結合が切断され、7 M塩酸グアニジンを含む10%酢酸 (pH 2.5)ではAsp-Pro結合が切断されます。このような化学的な切断法では、反応条件をきびしく選択して副反応を避けることが必要です。
図5-1にはラクトフェリンの限定分解物の分離パターンと、この抗体と反応するCローブ画分を示してあります。Cローブに対して上述の方法でさらに小さいペプチドを生成させました。逆相クロマトグラフィーによってこの反応生成物に含まれるペプチドパターンを調べ、さらにモノクローナル抗体と反応する画分を得ました。このような逆相クロマトグラフィー操作によって分離された各画分中に含まれる成分がモノクローナル抗体と反応するかどうかを調べるために、まず画分中に含まれる有機溶媒と酸を遠心減圧濃縮機によって除きました。さらに必要なら塩基性物質で中和してpHを中性にします。次いでELISA法あるいはニトロセルロース膜を用いたドットブロット(dot- blot)法を用いて検定を行ない、反応性を示す目的の画分を得ました。
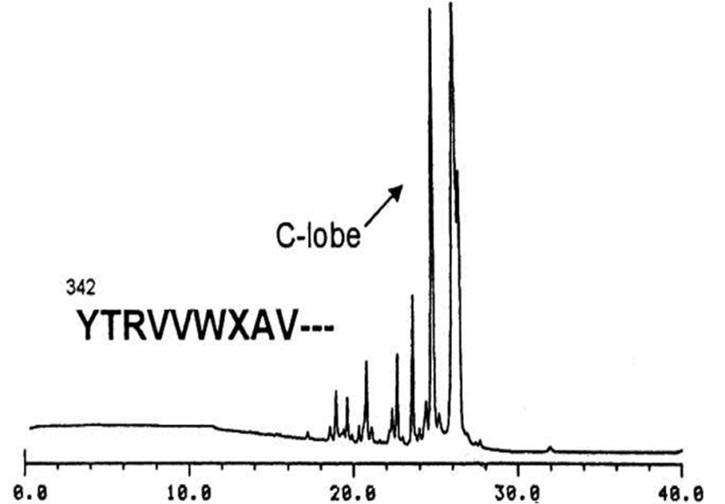
図5-1.ウシラクトフェリン(ホロタイプ)のトリプシン分解物の分離パターン2) 。矢印は342残基目から始まるCローブ。縦軸は吸光度(230 nm)、横軸は溶出時間(分)。用いたカラムはCAPCELL PAK C18カラム(資生堂)。
反応生成物中のペプチドパターンを調べる目的には、逆相クロマトグラフィーの他に各種のゲル電気泳動やキャピラリー電気泳動も用いられます。なお、液体クロマトグラフィーによる分離システムについては次章を参照して下さい。
これまで述べたフラグメントを得る方法は、純粋なタンパク質溶液を出発点としたものでした。複数のタンパク質を含む材料から出発して、目的タンパク質のフラグメントを得る方法には、まずポリアクリルアミドゲル電気泳動を行ったゲルから目的タンパク質を抽出し、プロテアーゼを作用させて得られた反応物から逆相クロマトグラフィーで各成分を分画する方法があります。あるいは電気泳動後のゲル中に存在する目的タンパク質に対してプロテアーゼを反応させてフラグメントを得る方法(in gel digestion法)も用いられます。ゲルからニトロセルロース膜やPVDF膜に転写した上での操作については、微量でも定量的に目的タンパク質を還元アルキル化し、かつ損失なしに酵素消化が可能だといわれています。この方法は第9章で述べるアミノ酸配列を決める場合に特に有効です。PVDF膜に固定化されたタンパク質をプロテアーゼで断片化する場合は、回収できなかったフラグメントを膜上で再び断片化の処理を行い、さらに短鎖のペプチドとして回収できます。なお、関連した事項は第8章にも述べています。

























