あるアミノ酸配列が特定の機能を示すことを証明するには、その配列を有するペプチドを合成し、反応性を調べることが必要です。ペプチドを化学合成するには、カルボキシル基と側鎖の反応性基(官能基、functional group)に保護基を付けたアミノ酸誘導体と、アミノ基と側鎖の官能基を保護したアミノ酸誘導体とを、カルボジイミドなどを用いて縮合させ、その後にアミノ基の保護基を外して次の保護アミノ酸を結合させる方法がとられます。この反応を行うには液相法と固相法がありますが、かなり大量に合成する以外はもっぱら固相法が用いられます。特にアミノ酸配列依存の抗原決定基の同定のために開発された方法があり、セルロース膜あるいはプラスチック製ピンの先端を化学処理し、先端にアミノ基をつけたスペーサーアームが用いられています。後者は96穴のプレートに入れた反応溶液を順次反応させてペプチド鎖を伸長させる方法(マルチピンペプチド合成法)です。この場合、抗体との反応はマイクロプレートを使います。
活性化セルロース膜を用いる方法(Sigma Genosys社のSPOTs)は、以下のようにして行ないました。すなわち、αアミノ基を9-フルオレニルメトキシカルボニル(Fmoc)で、同じくカルボキシル基を活性エステル(Opfp)あるいは(Odhbt)で保護したアミノ酸誘導体溶液を、膜のマークされた位置に1µL程度(Fmocアミノ酸100 -200μgに相当)をスポットします。この指定の位置にはスペーサーアームが結合し、その先端に遊離のアミノ基があるためにブロムフェノールブルー(BPB)で青く呈色しています。これらのアミノ酸誘導体は1-methy-2- pyrolidinone (NMF) に溶解して用います。膜上のアミノ基と活性エステルが反応し、ペプチド結合(またはアミド結合)が形成されます。過剰のアミノ酸誘導体をジメチルホルムアミド(dimethylformamide, DMF)で洗い流した後、未反応アミノ基を無水酢酸/DMFで処理することによりアセチル化し、反応性を失わせます。これをキャッピングといいます。次いで第2級アミンであるピペリジン(piperidine)/DMFによってアミノ基を保護していたFmoc基を外し、アミノ基を遊離させて次の伸長反応を行ないます。なお、反応性を有する側鎖はt-ブチルアルコール系の保護基(Pmc, OtBu, Trt, tBoc, tBuなど)で保護しておき、全ての合成が終了した時点でジクロロメタン(DCM)/トリイソブチルシラン(triiso- butylsilane)と混合したトリフルオロ酢酸(TFA)で保護基を外します(脱保護化)。
膜上の合成部位に反応させるアミノ酸誘導体を順次選択することで、一枚の膜に96種類の異なるアミノ酸配列を有するペプチドを一度に合成することが可能です。このようにして作成したペプチドライブラリーを用いて抗原結合部位の解析、リガンド結合部位の解析などが可能となります。また、このような手法をペプチドマッピングあるいはプロテインマッピングと呼ぶこともあります。なお、ここで述べたペプチドの合成方法は特別な装置は不要で、各種試薬類と有害な溶媒を扱うための換気装置があれば行うことができます。
合成するペプチドのアミノ酸配列を選択するには第6〜8章で述べた結果を基にします。ただしこの合成システムでは最大15残基までの合成とされています。また、ペプチドの全長を合成してもそのどこが抗体結合部位かを判定できないために、例えば8〜10残基を合成します。その場合、1ないし2残基づつずらして合成します(図10-1,2)。また、抗体結合部位(エピトープ)を含むと推定されるアミノ酸残基の前後を短くして合成し、抗体との結合性を示す最小単位を見つけます。さらにいくつかのアミノ酸残基を例えばGlyやAlaに置換して、確認します。

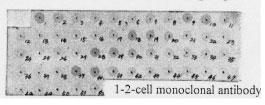
ウシラクトフェリンCローブに対するモノクローナル抗体反応部位(エピトープ)を推定するためにSPOTsによって作成したペプチドライブラリー1)
太字(No.3 & 4)は抗Cローブモノクローナル抗体と反応したペプチドを示します。ペプチド鎖を伸長させる順は、例えば1番目のペプチド(TAGWNIPM)で説明すると、C末端側であるMを最初に担体と反応させ、次いでP,I・・最後にN末端アミノ酸となるTを反応させます。
上記の方法で膜の上に合成したペプチドライブラリーを用い、まずモノクローナル抗体と反応させた後、二次抗体として酵素標識した抗マウスIg抗体を反応させます。モノクローナル抗体と反応するペプチドの検出には、標識酵素としてβガラクトシダーゼを用いた場合はX-gal、ペルオキシダーゼの場合は過酸化水素とAECを反応させます(表4-1参照)。呈色した部分のペプチドが反応性を有することを意味します。なおこの時に用いる色素は、酵素によって反応した後に不溶性となる点がELISA法の場合と異なります。これら反応性を示したペプチドのアミノ酸配列で重複している部分がその抗原決定基であることが分ります。
なお、単離した合成ペプチドを得る場合は、ビーズやカラムを用いた固相重合法で合成した後に担体から切り離し、クロマトグラフィーによって精製します。たとえば分取用サイズ(21.5 mm ID × 30 cm)のC18カラムでは一度に20 mg程度のペプチドを精製できます。また、この合成法では20〜30残基までのペプチドの合成が可能とされていますが、中間体の精製が不可能なため、最終産物の精製が困難な場合があります。一方、前述したように、オリゴペプチドの大量合成に向いているのは液相法で、これは縮合反応を均一溶媒中で行い、縮合反応物を各段階で単離しながらペプチド鎖を合成する方法です。しかし、合成したペプチドの溶解性が低い場合は精製が困難となります。さらに長いペプチドを得るためには、合成したペプチドをさらに結合させるフラグメント縮合法が用いられます。

ウシラクトフェリンNローブに対するモノクローナル抗体反応部位(エピトープ)を推定するためにSPOTsによって作成したペプチドライブラリー2)
これらのペプチドは1残基づつずらして合成(41-50)したり、あるいはペプチド鎖を短くして合成(41,28,18,10,1)しています。結果については図10-3に示しました。