これまでの実験操作によって、モノクローナル抗体を作成した抗原から、抗体との反応性を保持したペプチドを得ました。次の段階は、そのペプチドの大きさを正確に知り、さらに一次構造すなわちアミノ酸配列を決めることです。そこで、まずそのペプチドの質量を正確に知るために、MALDI-TOF MSによる測定を行いました。この測定方法は試料のイオン化のためにレーザー光(波長337 nm)のパルス照射を用いる方式で、イオン化促進試薬(マトリックス)が励起状態になり、そこから得られるエネルギーで試料が蒸発し、真空中でプロトン移動などによってイオン化します。このイオン化した試料は加速電圧によって運動エネルギーを得、フライトチューブ中を検出器に向かって飛行します(図7-1)。
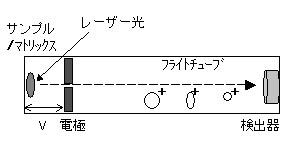
図7-1. MALDI-TOF MSのフライトチューブの模式図。フライトチューブ中は真空(10-6 Torr)。
この時、試料分子の質量の大小によって飛行時間に差が現れ、小さい分子ほど早く検出器にまで到達します。一般に、測定可能範囲は500 kDa位まで、分解能は5,000以上、測定質量精度は0.01%程度です。この意味は10,000 Daの物質を測定した場合、誤差は0.5 Da以内になるということです。ただし、測定精度はキャリブレーション(較正)の仕方で変わり、一般に内部標準法の方が外部標準法よりも高くなります。
ペプチド試料の場合は0.1 % TFAに5〜10 pmol/µLに溶解し、イオン化促進試薬を10 mg/mL程度の濃度でTFA(0.1%)/アセトニトリル/水(1:1)に溶解します。ペプチド量が0.5〜2 pmol/µLとなるように両者を混合します。なお、測定に必要な量は物質によって異なり、タンパク質では1〜10 pmol/µL、酸性オリゴ糖では10〜20 pmol/μlです。
このようにして調製した試料を金属製のサンプルプレートの所定の位置(直径2mm)に1µLほど滴下し、乾燥させます。この時、イオン化促進試薬は結晶として析出しますが、この結晶の状態が目的物質のイオン化に大きく寄与するため、イオン化促進試薬の溶媒組成や混合の仕方が良い結果を得るキーポイントとなります。ペプチドの場合、質量が1000未満はα-CHCA (α-cyano-4-hydroxy cinnamic acid)が、1000以上はシナピン酸(sinapinic acid)が使われます。その他にこれらよりも冷たいDHB (2,5-di¬hydroxybenzoic acid)も使われます。また、タンパク質の分析にはHABA (2-(4-hydroxy¬phenylazo)benzoic acid)が使われ、さらに2種類を混合して使用する場合もあります。再結晶などで精製したほうが、タンパク質の解析には良いようです。
あるいはイオン化促進試薬溶液の被膜をサンプルプレート上に作った後に試料溶液を載せる方法(thin-film法)もあります。また、等電点電気泳動を行ったポリアクリルアミドゲル内に含まれるペプチドや、ゲルから膜に転写してサンプルプレートに貼り付けて分析した大胆な例もあります。これらの場合はイオン化促進試薬溶液を直接にスポットしています。試料中に塩や界面活性剤が含まれているとS/N比が上がらないため、サンプルプレート上で試料の洗浄・脱塩(オンプレート洗浄)を行う方法もあります。
一般にはポジティブ(イオン)モードで測定しますが、リン酸化あるいは硫酸化されたペプチド、オリゴヌクレオチド、RNA、酸性オリゴ糖などはネガティブ(イオン)モードで測定します。また、図7-1に示した例はリニアモードといわれるもので、フライトチューブをより長くした方が分離能も向上します。そこで試料イオンに2次加速電圧をかけて進行方向を逆向きに戻し、実質的に飛行距離を伸ばした効果を得るのがリフレクターモードです。
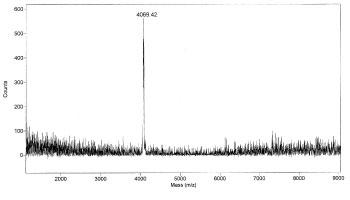
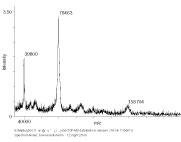
図7-2. MALDI-TOF MSによって測定された質量スペクトルの一例1)。試料はウシラクトフェリンから得た抗Cローブモノクローナル抗体結合性ペプチドで、ピリジルエチル化した後、endoglycosidase Hによる脱グリコシル化処理を行ったものです。
抗Cローブモノクローナル抗体結合性ペプチドの質量を測定する場合には、シナピン酸(sinapinic acid)をイオン化促進試薬として用い、質量の標準品としてアンジオテンシンI(ヒト、質量 1296.49)を用い、ポジティブモードを用いました。その結果、質量[M + H]+ として4069.42の値が得られました(図7-2)。ここでzはイオンの価数です。
なお、MALDI-TOF MSは測定可能範囲が広く、タンパク質の質量決定も可能です。しかし、ペプチドの場合に比べると、質量のはるかに大きいタンパク質ではきれいなピークを得るのはなかなか難しいようです。また、一般に高い分解能で同位体ピークが分離されて観測される場合には、単一同位体のピークの値をm/z実測値(monoisotopic mass)とし、分解能が低くて同位体ピークが分離されない場合には、ピークの重心の位置をm/z実測値(average mass)とします。
分析機器の制御のため、パーソナルコンピュータあるいはワークステーションが用いられますが、得られたデータを解析するためのソフトウエアも付属しています。機器に付属のコンピュータを占有しないために測定データを他のコンピュータに移行させて処理するためのソフトウエアや、さまざまなエクスポート形式もサポートされており、いざとなれば一般的な表・グラフ作成用ソフトウエアで処理することもできます。