
RhoA のリン酸化はシグナル伝達を調節する
Rho ファミリー GTP アーゼは、細胞運動、細胞分裂、神経発生などの幅広い生理的プロセスにおいて、重要な調節因子として機能しています1。Rho 活性は、プレニル化、ユビキチン化、酸化、ニトロシル化、リン酸化などの直接的な翻訳後修飾(PTMs)によって、時間的・空間的に制御されています(図1)。本稿では、リン酸化を介した RhoA 機能の調節にフォーカスします。RhoA をターゲットとするキナーゼについての報告は増加しており、リン酸化は Rho ファミリータンパク質の調節に関して中心的なテーマとなりつつあります2。
RhoA (188番目のセリン残基)リン酸化のメカニズム
RhoA をリン酸化するキナーゼは、in vitro および in vivo の両方で数種類報告されています(表1)。主に注目されているのは、RhoA の188番目のセリン残基をリン酸化する PKA と PKG です。また、SKL(Ste20-related kinase)や AMPKα1 (AMP-activated protein kinase subunit α 1) などのキナーゼも、RhoA を修飾することが報告されています(表1)。
Lang らは、初期に行った in vitro での研究で、PKA によって188番目のセリン残基がリン酸化されると、RhoA が不活性化されることを示しました3。この結果は、膜結合型 RhoA-GTP が PKA によってリン酸化され、その結果として生じる膜結合型リン酸化 RhoA-GTP が Rho GDI(guanine nucleotide dissociation inhibitor)の基質となり、RhoA-GTP を細胞質に移行させるというメカニズムを支持しています3。しかし、このメカニズムは、不活性型 Rho-GDP が GDI の基質となり細胞質へ移行するという、従来の Rho サイクリングモデルとは異なっています1。以上のことから、リン酸化によって、Rho-GTP が膜の作用部位から遊離して不活性化される、というメカニズムが考えられます。
| キナーゼ | リン酸化を受ける RhoA アミノ酸 | 結果 | 参考文献 |
|---|---|---|---|
| PKA | Ser188 | Rho GDI が関与すると考えられるメカニズムにより、膜から細胞質への移行を介して RhoA-GTP を不活性化 | 3,4 |
| PKA | Ser188 | RhoA を保護 特に、ユビキチンを介した分解から活性型 RhoA を保護 |
7 |
| PKG | Ser188 | RhoA の膜から細胞質への移行を促進し、細胞質の RhoA レベルを増加させる | 6 |
| PKG | Ser188 | 一酸化窒素の血管拡張作用 | 16 |
| AMPKα1 | Ser188 | エストラジオールの血管保護効果 | 12 |
| Mst3 | Ser26 | RhoA 活性を低下させ、発生中の脳においてニューロンの放射状移動を可能にする | 17 |
この in vitro での報告は、in vivo において、リン酸化を模倣した RhoA コンストラクトをトランスフェクションした結果によって支持されます。この実験系で長時間観察を行ったところ、NIH 3T3 細胞をフィブロネクチン上に播種した 15〜30分後に、RhoA リン酸化(188番目セリン残基)の増加と相関して RhoA 活性が低下しました4。また、この結果は、細胞の伸展の際に PKA レベルが上昇するという報告とも一致しています5。さらに、3T3 細胞における PKA を介したストレスファイバーの崩壊は、非リン酸化型変異体である RhoA-S188A 発現細胞において、完全に阻害されることが報告されています4。同様に、3T3 細胞において恒常的活性型 PKG によって誘導されるストレスファイバーの崩壊は、RhoA-S188A 発現細胞において阻害されました6。これらの報告から、RhoA は、in vivo において PKA と PKG によってリン酸化されることが示されます。興味深いことに、血管平滑筋細胞において RhoA の188番目のセリン残基がリン酸化されると、Rho GDI と複合体を形成することにより、細胞質のリン酸化 RhoA-GTP をユビキチンを介する分解から保護します7。この結果を支持する報告として、血管平滑筋において、内在性 PKG 活性の刺激により、細胞質の RhoA-GTP が蓄積することが示されています7。
これらの報告から、リン酸化は、活性型 RhoA が膜の作用部位から遊離し、細胞質へ移行して蓄積する過程を制御することで、直接 RhoA を調節するメカニズムであり、また、従来のGTPアーゼサイクルの代替となる可能性があります。脱リン酸化が起こると、細胞質に蓄積された RhoA-GDP が Rho GDI から解離して膜に戻り、エフェクターと相互作用してシグナル伝達を行うと考えられます3。この仮説は、まだ正式には証明されていませんが、リン酸化 Rho-GTP の Rho GDI への親和性が増加すると、血管平滑筋細胞において Rac1 が活性化されることが報告されています8。この結果は、一部の Rho GDI プールを隔離することで、Rho ファミリータンパク質がバランスのとれた状態で調節されるという報告と一致します9。
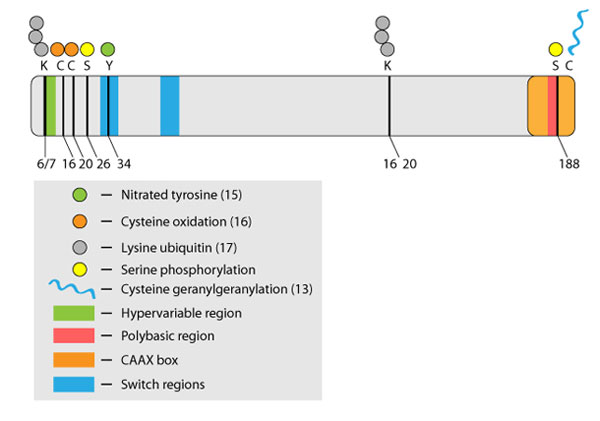
図1 RhoA の翻訳後修飾
RhoA リン酸化の生理学的な重要性
RhoA のリン酸化を誘導すると、培養細胞においてアクチンストレスファイバーの劇的な崩壊が起こり、非リン酸化型変異体によってレスキューされることから、リン酸化は、RhoA の生理的な調節において重要な役割を果たしていると考えられます。また、RhoA/ROCK 経路の過剰な活性化は、肺高血圧症などの血管障害の要因となることが知られています10。RhoA の 188番目のセリンのリン酸化による不活性化は、これらの疾患に対する治療アプローチの一つとなる可能性があります11。また、高血圧に対する抑制作用や血管保護作用が知られているエストロゲンは、AMPKα1キナーゼを活性化することで RhoA の188番目のセリンのリン酸化を引き起こします12。さらに、RhoA の188番目のセリンのリン酸化は、細胞障害性T細胞の cAMP への生理的応答を調節し、結果として細胞溶解を阻害することが示されています。このメカニズムには、cAMP によって活性化された PKA による RhoA のリン酸化に応答して細胞骨格が再構成されることで起こる、接着分子の親和性の変化が関連していると考えられます。このことは、細胞障害性T細胞が一つのターゲットから別のターゲットへと変更する能力についての説明となる可能性があります3。さらに別の例を挙げると、RhoA の188番目のセリンのリン酸化は、前立腺癌におけるアンドロゲン除去療法中の神経内分泌細胞の発生に関連しています。この症例は予後不良につながることから、RhoA のリン酸化経路に対する薬物療法は、前立腺癌治療に有用となる可能性があります13。
まとめと今後の展望
RhoA の調節に関連するキナーゼについての報告が増加しています。また、RhoA やその他の Rho ファミリーのメンバーを直接調節する翻訳後修飾に関する報告も増加しています。Rho タンパク質は、多くの疾患で非常に重要な役割を果たしていることから、 RhoA の翻訳後修飾は治療の対象として注目されています14。一般的に、基礎研究で RhoA 活性を測定するには、様々な Rho 活性化アッセイを利用して、細胞や組織における活性型 GTP結合 RhoA の相対的な増加量を定量します15。Rho の翻訳後修飾は、Rho を直接調節する重要なメカニズムの一つであることが明らかになってきています。これらのメカニズムがどのように統合され、相互作用しているかを解明することで、疾患および正常状態における Rho ファミリーの調節に関して、さらなる知見が得られることが期待されます。
アセチルリジン マウスモノクローナル抗体
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥32,000 |
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥114,000 |
ユビキチン マウスモノクローナル抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥32,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
¥114,000 |
G-LISA® 活性型低分子量Gタンパク質定量キット
- G-LISA® 活性型低分子量Gタンパク質定量キット
- 少量のサンプルから、3時間以内で活性型低分子量Gタンパク質を測定するキット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
¥280,000 |
Cdc42 G-LISA(R) Activation Assay Kit |
CYT | BK127 | 96 ASSAY |
¥280,000 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥280,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
¥280,000 |
【関連商品】
- RhoA / Rac1 / Cdc42 G-LISA 活性型低分子量Gタンパク質アッセイ バンドルキット(24アッセイ/キット)
- お得なRhoA / Rac1 / Cdc42 各アッセイキットのセット品!
活性型低分子量Gタンパク質 プルダウンアッセイ Biochem Kit™
- 活性型低分子量Gタンパク質 プルダウンアッセイ Biochem Kit™
- 低分子量Gタンパク質活性化を、プルダウンアッセイで簡単に検出!
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoA Pulldown Activation Assay Kit |
CYT | BK036 | 1 KIT [80 assays] |
¥241,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034 | 1 KIT [50 assays] |
¥241,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥225,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
¥241,000 |
細胞透過性 Rho 阻害剤
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-A | 1*20 UG |
¥63,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-B | 5*20 UG |
¥205,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-C | 20*20 UG |
お問い合わせ |
参考文献
- Stankiewicz T. & Linseman D. 2014. Rho family GTPases: key players in neuronal development, neuronal survival and neurodegeneration. Front. Cell. Neurosci. doi: 10.3389/fncel.2014.00314.
- Boulter E. et al. 2012. Off the beaten paths: alternative and crosstalk regulation of Rho GTPases. FASEB J. 26, 469-479.
- Lang P. et al. 1996. Protein kinase A phosphorylation of RhoA mediates the morphological and functional effects of cyclic AMP in cytotoxic lymphocytes. EMBO J. 15, 510-519.
- Ellerbrock S. et al. 2003. Serine phosphorylation negatively regulates RhoA in vivo. J. Biol. Chem. 278, 19023-19031.
- O’Connor K.L. & Mercurio A.M. 2001. Protein kinase A regulates Rac and is required for growth factor-stimulated migration of carcinoma cells. J. Biol. Chem. 276, 47895-47900.
- Sawada N. et al. 2001. cGMP-dependent protein kinase phosphorylates and inactivates RhoA. Biochem. Biophys. Res. Commun. 28, 798-805.
- Rolli-Derkinderen M. et al. 2005. Phosphorylation of serine 188 protects RhoA from ubiquitin/proteasome-mediated degradation in vascular smooth muscle cells. Circ. Res. 96, 1152-1160.
- Rolli-Derkinderen M. et al. 2010. RhoA phosphorylation induces Rac1 release from guanine dissociation inhibitor alpha and stimulation of vascular smooth muscle cell migration. Mol. Cell Biol. 30, 4786-4796.
- Boulter E. et al. 2010. Regulation of Rho GTPase crosstalk, degradation and activity by RhoGDI 1. Nature Cell Biol. 12, 477-483.
- Montani D. et al. 2014. Targeted therapies in pulmonary arterial hypertension. Pharmocol. Ther. 141, 172-191.
- Zhao Y. et al. 2012. Protein kinase G-1 deficiency induces pulmonary hypertension through RhoA/Rho kinase activation. Am. J. Path. 180, 2268-2275.
- Gayard M. et al. 2011. AMPK alpha 1-induced RhoA phosphorylation mediates vasoprotective effect of estradiol. Artherioscler. Thromb. Vasc. Biol. 31, 2634-2642.
- Jones S. & Palmer T. 2012. Protein kinase A-mediated phosphorylation of RhoA on serine 188 triggers the rapid induction of a neuroendocrine-like phenotype in prostate cancer epithelial cells. Cell. Signal. 24, 1504-1514.
- Konstantinopoulos P. et al. 2007. Post-translational modifications and regulation of the RAS superfamily of GTPases as anticancer targets. Nat. Rev. 6, 541-555.
- http://www.cytoskeleton.com/activationassayvideo.
- Sauzeau V. et al. 2000. Cyclic GMP-dependent protein kinase signaling pathway inhibits RhoA-nduced calcium sensitization of contraction in vascular smooth muscle. J. Biol. Chem. 275, 21722-21729.
- Tang J. et al. 2014. Cdk5-dependent Mst3 phosphorylation and activity regulate neuronal migration through RhoA inhibition. J. Neurosci. 34, 7425-7436.
- Rafikov R. et al. 2014. Lipopolysaccharide-induced lung injury involves the nitration-mediated activation of RhoA. J. Biol. Chem. 289, 4710-4722.
- Heo J. & Campbell S.L. 2005. Mechanism of redox-mediated guanine nucleotide exchange on redox-active Rho GTPases. J. Biol. Chem. 280, 31003-31010.
- Sahai E. et al. 2007. Smurf1 regulates tumor cell plasticity and motility through degradation of RhoA leading to the localized inhibition of contractility. J. Cell Biol. 176, 35-42.
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る