
タンパク質調節に不可欠な翻訳後修飾
細胞は、恒常性を維持するために、細胞内および細胞外環境の変化に対応する必要があります。変化の中には、細胞損傷や細胞死につながる有害な影響を避けるために、迅速に起こるものがあります。タンパク質の翻訳後修飾(PTM)は細胞の方略のひとつであり、多くのタンパク質の特性(酵素活性、タンパク質相互作用、細胞内局在など)に影響を与えることにより、細胞が様々な変化に迅速に対応することができます。質量分析(MS)の発達により、大規模なPTMの同定が可能になりました。今日では、小さな化学的修飾(例: リン酸化やアセチル化)から、完全なタンパク質の付加(例: ユビキチン化やSUMO化)に至るまで、200を超えるPTMが知られています1,2。最も広く研究されているPTMは、プロテインキナーゼがセリン、スレオニン、チロシン残基にリン酸基を付加するリン酸化です。リン酸化されたタンパク質は、多様かつ重要な細胞プロセスにおいて、きわめて重大な役割を果たしていると考えられます。ヒストンタンパク質のアセチル化は、約50年前に発見され3、クロマチン構造の調節に関与することが知られてきました4。プロテオミクス研究により、約 2,000 タンパク質に渡って、5,000 のアセチル化部位が同定されました5,6。アセチル化タンパク質の大部分は、細胞質、ミトコンドリア、細胞膜に局在することから、シグナル伝達、細胞骨格のダイナミクス、膜の安定性などの多様な細胞プロセスに関与していると考えられます5,6。リジン残基は、アセチル化に加えて、ユビキチン化やSUMO化によって修飾されることが報告されており、ユビキチン化はプロテアソーム経路を介したタンパク質分解において重要な役割を果たし7、SUMO化は細胞周期、アポトーシス、DNA修復、シグナル伝達経路などの細胞プロセスの調節において重要です8。
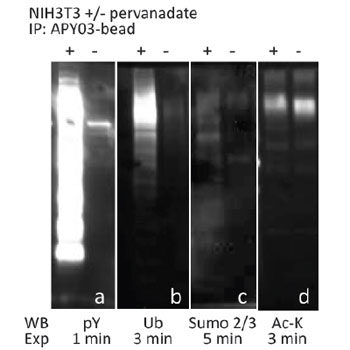
図1 過酸化水素・過バナジン酸ナトリウムで処理/未処理の NIH3T3 細胞のライセートを、ホスホチロシン抗体(品番: APY03)-ビーズとインキュベートし、チロシンリン酸化タンパク質を濃縮した。 PTMtrue™ 抗体を用いてウェスタンブロット解析し、濃縮されたチロシンリン酸化タンパク質(pY)から、複数の翻訳後修飾を受けたタンパク質(1B-1D)を検出した。
PTMのクロストーク
PTMのクロストークは、最近、プロテオミクス研究領域で注目されています。二つの別の研究グループが、バイオインフォマティクスとタンパク質配列のデータベース解析により、異なる種類のPTMが近接して(約アミノ酸15残基離れて)位置する「ホットスポット」を同定しました9,10。これらの「ホットスポット」は、クロストークする場合があることが報告されています1,2。濃縮方法や質量分析(MS)技術の発達により、複数の研究グループが、細胞環境における包括的なPTMのプロテオーム解析を行っており11-13、タンパク質分解11 および SUMO化が調節するタンパク質リン酸化(例: カゼインキナーゼ II)において、リン酸化とユビキチン化とがクロストークすることが示されました12。PTMのクロストークには、ネガティブとポジティブが存在します。ポジティブなクロストークでは、最初のPTMが次のPTMの追加/除去のシグナルとして作用するか、次の修飾を行う結合タンパク質の認識シグナルとして作用します(例: リン酸化に依存したSUMO化)14。ネガティブなクロストークでは、タンパク質中の1つの残基の修飾のために直接的に競争するか15,16、次のPTMの認識部位をマスクことで間接的に作用します15,16。また、1つのタンパク質が複数の修飾を受けることを示す多くの例があります1。このようなPTMの作用が組み合わさることによって、真核生物におけるプロテオーム研究の幅が広がり、また、タンパク質の機能、局在、他の分子との相互作用などを微調整するメカニズムとなり得ます。
Cytoskeleton社では、目的のタンパク質のPTMの研究に使用できる、PTMtrue™ 抗体をご提供しております。最近では、抗ホスホチロシン(pY)抗体(品番: APY03) および 抗 SUMO-2/3 抗体(品番: ASM24)とプロテインGビーズを架橋した、PTM 濃縮ビーズを開発しました。図1および図2は、Cytoskeleton社の PTM 濃縮ビーズを使用して、複数のPTMを受けたタンパク質を検出した結果を示しています。チロシンリン酸化タンパク質を濃縮するために、過酸化水素・過バナジン酸ナトリウムで処理/未処理の NIH3T3 細胞のライセートを、ホスホチロシン抗体(品番: APY03)-ビーズとインキュベートしました。SUMO-2/3 標的タンパク質の濃縮は、ヒートショック処理/未処理の HeLa 細胞ライセートを PTM 濃縮ビーズとインキュベートすることで行いました。濃縮したタンパク質をビーズから溶出し、SDS-PAGE ゲル上で分解しました。その後、タンパク質を PVDF 膜に転写し、PTMtrue™ 抗体[抗pY(品番: APY03)、抗SUMO-2/3(品番: ASM23)、抗ユビキチン(品番: AUB01)、抗アセチルリジン(品番: AAC01)]を用いて、濃縮プール中の特定のPTMを受けたタンパク質を検出しました。図1Aおよび図2Aに示すように、2種類の濃縮ビーズはどちらも、PTMを受けた標的タンパク質に対して、優れたプルダウン能力を示します。また、PTMtrue™ 抗体を用いて、pY および SUMO-2/3 濃縮プールから、複数のPTMを受けたタンパク質を検出することも可能です(図1B-D; 2B-D)。
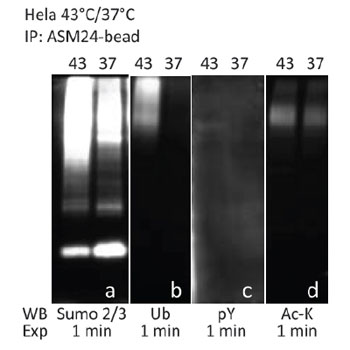
図2 ヒートショック(43℃)処理/未処理の HeLa ライセートを PTM 濃縮ビーズ(品番: ASM24-BEADS)とインキュベートし、SUMO-2/3 標的タンパク質を濃縮した。PTMtrue™ 抗体を用いたウェスタンブロット解析により、SUMO-2/3 濃縮プールから、複数のPTMを受けたタンパク質(2B-2D)を検出した。
まとめ
PTMのクロストークの研究には、2つの障害が存在します。1つは、PTMは多くの場合、準化学量論的な(モル比で少ない)レベルで存在するため、非常に特異的な方法で濃縮する必要があることです。もう1つは、プロテオミクス研究には、一般的に、インタクトなタンパク質の代わりにトリプシンで消化されたペプチドが用いられるため、多くの場合、1つのタンパク質アイソフォーム上に存在する複数の修飾の関連性が断たれてしまうからです。Cytoskeleton社では、内在性レベルのPTMタンパク質を検出し濃縮する、非常に特異的な PTM 抗体をご提供しております。
参考文献
- Minguez P. et al. 2012. Deciphering a global network of functionally associated post-translational modifications. Mol. Syst. Biol. DOI: 10.1038/msb.2012.31.
- Beltrao P. et al. 2013. Evolution and functional cross-talk of protein post-translational modifications. Mol. Syst. Biol.DOI: 10.1002/msb.201304521.
- Allfrey V.G. & Mirsky A.E. 1964. Structural modifications of histones and their possible role in regulation of RNA synthesis. Science. 144, 559.
- Pazin M.J. & Kadonaga J.T. 1997. What’s up and down with histone deacetylation and transcription? Cell. 89, 325-328.
- Kim S.C. et al. 2006. Substrate and functional diversity of lysine acetylation revealed by a proteomics survey. Mol. Cell. 23, 607-618.
- Choudhary C. et al. 2009. Lysine acetylation targets protein complexes and co-regulates major cellular functions.Science. 325, 834-840.
- Ciechanover A. et al. 2005. Proteolysis: From the lysosome to ubiquitin and the proteasome. Nat. Rev. Mol. Cell Biol. 6, 79-87.
- Hay R.T. et al. 2005. SUMO: A history of modification. Mol. Cell. 18, 1-12.
- Minguez P. et al. 2012. PTMcode: A database of known and predicted functional associations between post-translational modifications in proteins. Nucleic Acids Res. 41, D306-D311.
- Lu Z. et al. 2011. Bioinformatic analysis and post-translation modification crosstalk prediction of lysine acetylation.PLoS ONE. 6, e28228.
- Swaney D. el al. 2013. Global analysis of phosphorylation and ubiquitylation crosstalk in protein degradation. Nat. Methods. 10, 676-682.
- Yao Q. et al. 2011. SUMOylation-regulated protein phosphorylation, evidence from quantitative phosphoproteomics analyses. J. Biol. Chem. 286, 27342-27349.
- Mertins P. et al. 2013. Integrated proteomic analysis of post-translational modifications by serial enrichment. Nat. Methods. 10, 634-637.
- Su Y.-F. et al. 2012. Phosphorylation-dependent SUMOylation of the transcription factor NF-E2. PLoS ONE. 7, e44608.
- Hart G.W. et al. 2011. Cross talk between O-GlcNAcylation and phosphorylation: Roles in signaling, transcription, and chronic disease. Annu. Rev. Biochem. 80, 525-858.
- Wang Z. et al. 2008. Cross-talk between GlcNAcylation and phosphorylation: Site-specific phosphorylation dynamics in response to globally elevated O-GlcNAc. Proc. Natl. Acad. Sci. U.S.A. 105, 13793-13798.
PTMtrue™ 抗体
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出 - SUMO-2/3 アフィニティービーズ
- 免疫沈降(IP)によるSUMO化タンパク質の濃縮に最適
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥114,000 |
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥32,000 |
Anti Phosphotyrosine, (Mouse) , 27B10.4 |
CYT | APY03 | 2*100 UL |
¥114,000 |
Anti Phosphotyrosine (Trial Size), (Mouse) , 27B10.4 |
CYT | APY03-S | 1*25 UL |
¥32,000 |
Anti Phosphotyrosine, (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP | 1*100 UL |
¥130,000 |
Anti Phosphotyrosine (Trial Size), (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP-S | 1*25 UL |
¥41,000 |
Anti SUMO-2/3, (Mouse) , 12F3 |
CYT | ASM23 | 200 UL [2 x 100 μl] |
¥114,000 |
Anti SUMO 2/3 (Trial Size), (Mouse) , 12F3 |
CYT | ASM23-S | 25 UL [1 x 25 μl] |
¥32,000 |
Anti SUMO-2/3, (Mouse) , 11G2 |
CYT | ASM24 | 2*200 UL |
¥116,000 |
Anti SUMO-2/3 (Trial Size), (Mouse) , 11G2 |
CYT | ASM24-S | 1*150 UL |
¥41,000 |
| Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 | CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
¥176,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
¥114,000 |
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥32,000 |
ライブセルイメージングプローブ
- Spirochrome プローブ(SiR-Actin/SiR-Tubulin)
- STED顕微鏡での細胞骨格(アクチン・チューブリン)観察に最適
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥170,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥170,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する








 中身を見る
中身を見る 中身を見る
中身を見る 中身を見る
中身を見る
 中身を見る
中身を見る