金属イオンを結合しているタンパク質は数多くあります。ヘムタンパク質はその代表的なものです。その他に、活性を発現するために金属イオンを補因子として必要とする酵素類もあります。また、ラクトフェリン(lactoferrin)、トランスフェリン(transferrin)、オボトランスフェリン(ovotransferrin)、メラノトランスフェリン(melanotransferrin)などトランスフェリンファミリータンパク質と呼ばれる一群のタンパク質も金属イオン結合タンパク質です。
トランスフェリンファミリータンパク質
トランスフェリンファミリータンパク質であるラクトフェリンは、鉄イオンだけではなくその他の金属イオンも結合します。たとえば銅、アルミニウム、バナジウム、亜鉛、ガリウムなどとの結合が報告されています。鉄の場合は3価のイオンが結合します。結合する部位はNローブ(lobe)およびCローブに各一カ所づつあり、その結合には炭酸イオン(CO32-)も関与しています1)。また、鉄結合部位の直径は10Å程度で、ラクトフェリンに結合できるかできないかは、金属イオンの価数とイオン半径が関係しています。さらに、鉄が結合している状態と結合していない状態とで立体構造に僅かな変化が生じていることも観察されています1)。鉄飽和型(ホロ型)と鉄不飽和型あるいは遊離型(アポ型)のラクトフェリンでは、アポ型よりもホロ型の方がプロテアーゼに対する抵抗性が強く、このことを利用して、ホロ型ラクトフェリンにトリプシンを作用させて限定分解を行い、NローブとCローブを分離できます2)。
鉄イオンの付加と除去
ラクトフェリンの場合、鉄イオンの結合は可逆的です。鉄を結合していないアポ型のラクトフェリンを調製するには、図1-1に示したように、EDTAなどのキレート剤あるいはクエン酸溶液に対してラクトフェリンを透析します。逆に鉄イオンを結合させるには、炭酸イオン(CO32-)の存在下で3価の鉄イオン(Fe3+)、例えばクエン酸鉄アンモニウムや硫酸鉄などの溶液を加え、その後に過剰の鉄イオンを除くため、透析やアフィニティークロマトグラフィーを行います 3)。
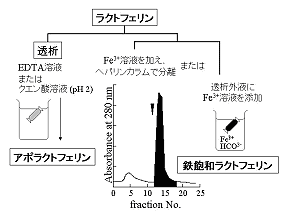
図1-1.鉄飽和(ホロ)型および鉄遊離(アポ)型ラクトフェリンの調製方法。
一般に0.1 Mクエン酸溶液(pH 2)や0.1% EDTA溶液(pHは中性)を用います。中央の図では、0.1% クエン酸鉄アンモニウム溶液をラクトフェリン溶液の1/10容を加え、過剰の鉄イオンをクロマトグラフィーで除きました。
鉄イオン飽和度の測定
ラクトフェリン分子に対する鉄イオン結合の割合(飽和度)は、純ラクトフェリン溶液では280 nmと465 nmでの吸光度から計算で求めることができます。これはアポ型とホロ型のラクトフェリンで、吸収スペクトルが異なるためです。ホロラクトフェリンでは280 nmの吸光度が大きく、かつ465 nmに小さいピークが現れます(図1-2)。アポおよびホロラクトフェリンの各波長での吸光度の値を表1-1に示しました。また、銅イオンを結合したラクトフェリンでは432 nmに吸収ピークが観察されます(表1-2)。
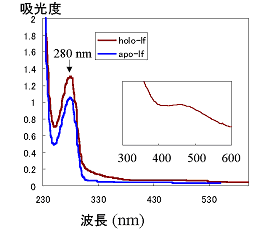
図1-2.ウシラクトフェリンの吸収スペクトル
挿入したスペクトルは300〜600 nmの範囲の吸収スペクトルを拡大したもの。
| 280nm | 465nm | |
|---|---|---|
| アポラクトフェリン | 12.7 | 0 |
| ホロラクトフェリン | 15.1 | 0.58 |
(光路長1cm、濃度1%の場合の値)
さまざまな物質が混在している場合のラクトフェリンの鉄飽和度は、原子吸光法あるいはその他の比色定量法によって求めた鉄の定量値から計算します。ラクトフェリン以外のタンパク質が含まれている試料中のラクトフェリン濃度の決定は、ラクトフェリンに対して特異的な方法を用いなければなりません(後述)。ちなみにヒトやウシのミルクから精製したラクトフェリンの鉄飽和度は10〜30%です。
なお、鉄イオンに限らず金属イオンの定量には原子吸光法、炎光分析法などが用いられます。タンパク質に結合した金属イオンについても、湿式灰化で、あるいは乾式で灰化した後に酸溶液に溶
かして分析します。その他に、キレート滴定法や比色法、さらにイオン電極による方法も用いられます。
| 結合金属イオン | Fe3+ | Cu2+ |
|---|---|---|
| ラクトフェリン | 465 nm | 432 nm |
| トランスフェリン | 464 | 440 |
| オボトランスフェリン | 460 | 440 |
鉄イオン結合能の簡易測定法
錠剤・顆粒・粉末などの形態の様々なラクトフェリン含有製品に含まれているラクトフェリンについて、その活性を測定する方法で最も簡便なのは、鉄イオンの結合能を測定することです。まず、試料中のラクトフェリンの鉄イオン飽和度を決定し、次いで図1−1に示した透析法で鉄を除いてアポ型とします。これに再度鉄イオンを飽和させる操作を行ってどの程度まで鉄イオンを結合できるか、すなわち鉄結合性の回復率を測定します。ラクトフェリン以外に他のタンパク質が含まれていない試料の場合には、ローリー(Lowry's)法、色素結合法(クマシーブリリアントブルー(CBB)を用いるブラッドフォード(Bradford)法やアミドブラック10Bを用いる方法など)、あるいは280 nmでの吸光度を測定するなどの一般的なタンパク質定量法を用います。なお、検量線を作成する場合には十分に精製されたアポラクトフェリンを用い、280 nmの吸光係数12.74)を用いて濃度を決定して作成します。しかし試料中にラクトフェリン以外のタンパク質が含まれている場合には、ラクトフェリンの量をELISAあるいは免疫拡散法などラクトフェリンに対する抗体を用いる免疫化学的方法で定量します。さらに測定試料中に鉄を結合する可能性のある他の物質が含まれている場合には、ラクトフェリンを精製するなどの前処理が必要となります。
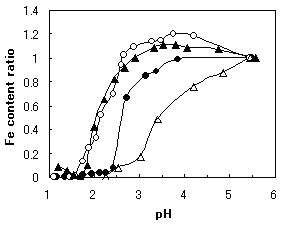
鉄イオンの結合強度の比較
トランスフェリンファミリータンパク質の鉄結合のpH依存性の測定から、それらの結合の強さが分かります。ラクトフェリン溶液のpHを徐々に酸性側に移行させると鉄イオンが遊離するので、ラクトフェリンの示す吸光度の変化から残存している結合鉄の割合いを測定することが出来ます。465 nmの吸光度の変化と280 nmの吸光度の変化とは並列なので、280 nmの吸光度を測定するほうが感度良く測定できます。ヒト、ウシ、ウマのラクトフェリンおよびウシトランスフェリンの鉄イオン遊離のpH依存性(図1-3)から鉄結合の強さを比較したところ、ウマラクトフェリン=ヒトラクトフェリン>ウシラクトフェリン>ウシトランスフェリンの順でした 5)。なお、ウシラクトフェリンはヒトトランスフェリンの鉄結合能よりも260倍強いと報告されています 6)。
金属結合性を利用したタンパク質の分離法
金属キレートアフィニティ(親和性)クロマトグラフィーは、金属結合性を利用したタンパク質の分離法です。たとえばイミノジ酢酸を反応させた担体に金属イオン(銅、亜鉛、ニッケル、クロムなど)を結合させ、これらと結合性を示すタンパク質を吸着させます7)。吸着にはpH8の、溶出にはpH4の緩衝液を用いています。なお、金属結合性を利用したタンパク質の分離法として、DNA操作で作成した組換えタンパク質の分離・精製を容易にする工夫があります。それは、ヒスチジン-タグ(His-tag)融合タンパク質を作り、金属イオンクロマトグラフィーによって分離するという方法です。