ミルクタンパク質、特にホエータンパク質には、各種の細胞あるいは微生物と結合性を示すものがあります。例えば免疫グロブリンは細胞表面に抗原を認識した場合に結合します。リゾチームは細菌の細胞壁に存在するムコペプチドを構成している成分を基質として認識して結合し、最終的にそれらを分解して殺菌作用を示します。αラクトアルブミンやβラクトグロブリンはある種の培養細胞に対してアポトーシスを引起すことが報告されています1)が、これにも細胞との何らかの相互作用が存在していると考えるべきでしょう。さらにラクトフェリンについては、多くの体細胞や微生物に結合することが報告されています。
| Stapylococcus aureus, Escherichia coli,Helicobacter pylori, Neisserraceae, Moraxella,原虫(toxoplasma, trypanosoma)、その他 |
細胞表面のレセプター
レセプター(あるいは受容体、receptor)は、細胞に特定の物質(リガンド)が結合する部位あるいは物質で、リガンド結合によって細胞に何らかの応答を引き起こす物質のことを意味します。ですから、レセプター構成物質はタンパク質のこともあり、また糖鎖の場合もあります。細胞あるいは微生物が外界から何らかの刺激を受ける場合、細胞表面でその刺激を捕捉し、細胞内にそのシグナルを伝達してゆきます。この過程のほとんどにレセプター機能が関与していると考えられます。
ラクトフェリンの場合、小腸上皮細胞、肝細胞、リンパ球などの表面、さらにある種の微生物の表面にラクトフェリン結合タンパク質が見出されています(表4-1)。これらラクトフェリン結合タンパク質がすなわちラクトフェリンレセプターであるというわけではありません。本章の後半で述べる小腸上皮細胞のラクトフェリンレセプターはその稀な例です。
微生物のラクトフェリン結合タンパク質
微生物もラクトフェリン結合性物質をそれらの表面に持っているものがあります(表4-1)。生育に鉄を必要とするE. coliなどは、菌体外に低分子量のキレート物質(シデロフォア(siderphore)と呼ばれる)を分泌して鉄イオンを取込む3)ことが知られていますが、ラクトフェリンレセプターを有する細菌では、ラクトフェリンを利用して鉄を取込む可能性が考えられています4)。一方、原虫であるトリパノソーマなどにもラクトフェリンの結合性が観察されていますが、その役割りはほとんど分かっていません。そのため、ラクトフェリン結合タンパク質が宿主と微生物のどちらにとって有利に働いているかは一概に言えないようです。また、以下に述べるように、人間の健康にとって有益なビフィズス菌にもラクトフェリン結合タンパク質が存在しています5)。
ラクトフェリン結合タンパク質の検出
ビフィズス菌の膜画分にラクトフェリン結合タンパク質が検出されたので、それを例に述べます。検出方法としては、まず対象としている菌を培養した後に、菌体を遠心分離操作によって培養液から分離して集めます。次に超音波処理や凍結融解処理などで菌体を破壊し、細胞膜画分とその他の細胞質画分とに分けます。細胞膜画分はさらに界面活性剤によって可溶化します。この場合、菌自体が持っているタンパク質分解酵素の影響を受けないように、各種のタンパク質分解酵素阻害剤を含む溶媒を用います。次いでSDS-ポリアクリルアミドゲル電気泳動(SDS-PAGE)によって細胞膜画分に含まれるタンパク質を各成分に分離し、ニトロセルース膜あるいはPVDF膜に転写します。これをウシ血清アルブミンなどによるブロッキング操作を行った後、ラクトフェリン溶液と反応させ、結合性タンパク質成分を検出します。この時、ビオチン化ラクトフェリンおよびペルオキシダーゼ標識アビジンを用います。
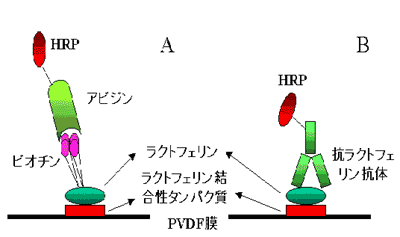
図4-1.ラクトフェリン結合性タンパク質検出の原理。Aはfar-Western法 (またはWestern- Western法)、Bは酵素標識抗体を用いる方法。HRPは西洋ワサビペルオキシダーゼの略。
その原理を図4-1-Aに示しました。この方法をfar-western法あるいはwestern-western法といいます。なお、抗ラクトフェリン抗体とペルオキシダーゼ標識した二次抗体、あるいは直接にペルオキシダーゼ標識した抗ラクトフェリン抗体がある場合には、図4-1-Bに示した方法もあり、操作数は少なくなりますが、非特異的な結合によるバンドの出現が多いようです。 なお、ビフィズス菌に限っても、ラクトフェリン結合タンパク質が検出されるかどうかは株によって異なります5)。また先に述べたように、ラクトフェリンを結合する物質であるからといって、即ラクトフェリンレセプターであるとはいえず、その機能の解明が必要です。
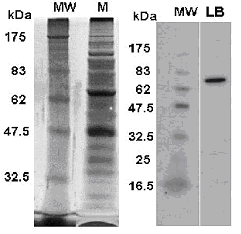
図4-2.Bifidobacterium bifidumから得た膜画分のSDS-PAGEパターン(銀染色法)および検出されたラクトフェリン結合タンパク質6)。MWは分子量推定用標準タンパク質、Mは膜画分。LBがラクトフェリン結合性タンパク質。
小腸上皮細胞のラクトフェリンレセプター
胎児あるいは新生児の小腸上皮細胞においてラクトフェリン結合タンパク質が同定され、レセプターであることが証明されつつあります7,8)。ここではそれらの実験に用いられた主な方法を簡略に述べます。まず、小腸上皮の刷子縁部分の細胞の膜を可溶化し、固定化ラクトフェリンカラムを用いてその成分中に含まれるラクトフェリン結合性タンパク質を分離しました。この時の可溶化にはTriton X-100を用いています。得られた目的タンパク質の分子量は非還元状態でのSDS- PAGEでは136 kDa、還元条件下では34 kDaと報告されています。さらに、Scatchardプロット(2章を参照)を用いて単位重量当りの膜タンパク質へのラクトフェリン結合部位数およびアフィニティー定数が求められています。また、このレセプタータンパク質の結合性はラクトフェリンに特異的であることを競合的結合実験で確かめています。
このタンパク質のN-末端アミノ酸配列、およびプロテアーゼ処理で得られたフラグメントのアミノ酸配列を決定し、次にこれらのアミノ酸配列に該当する塩基配列をヒトゲノム情報データベースから検索しました。見つかった配列情報に基づいてペプチドを化学的に合成し(構造編第10章参照)、そのペプチドに対する抗体を作りました(構造編第3章参照)。この抗ラクトフェリン結合タンパク質抗体を用いたウエスタンブロット法(構造編第4章参照)によって、培養細胞Caco 2が同じタンパク質を発現していることが確認でき、かつmRNAの発現も確認されました。また、ラクトフェリンレセプターの組換え体もバキュロウイルス系を用いて発現させ、ラクトフェリンとの結合能を測定しています。さらにCaco 2細胞にもこのレセプター遺伝子を組み込み、レセプター発現量を増大させて、鉄飽和ラクトフェリンの取り込みが多くなることを観察しています。なお、このタンパク質はこれまでインテレクチンと言われていたタンパク質と同一であることも分かりました8)。