リガンド(ligand)とは、ある物質(本章の場合はタンパク質)に対して特異的に結合する物質で、前章で述べた金属イオンもリガンドの一つです。リガンドが対象物質と結合する部分、すなわち結合部位(binding site)は決まっており、選択的(特異的)かつ高い親和性を有しています。ラクトフェリンにおいては、低分子物質(金属イオン、ある種の薬剤や色素など)から高分子物質(多糖類、タンパク質、核酸など)まで、さまざまな種類の物質と相互作用することが知られています。生体内においてラクトフェリンは多様な分子と共存し、かつ協同的に機能していると考えられるので、ラクトフェリンとこれらの物質との相互作用の機構を解明することは、ラクトフェリンの機能を解明する一端になると期待されます。
リガンド結合の解析
共有結合に比べて弱い結合である水素結合、イオン結合、ファンデル・ワールス力による結合および疎水性結合が、対象物質間の結合あるいは相互作用に関与しています。タンパク質とリガンドとの結合の例として、免疫グロブリンの示す抗原抗体反応は代表的なものの一つです。
抗体 + 抗原 ↔ 免疫複合体
これを一般化すると次のようになります。
タンパク質 + リガンド ↔ 複合体
この反応は可逆的なので、矢印が両方向を向いており、タンパク質にn個のリガンドが結合した平衡(equilibrium)状態にある場合の結合定数(binding constant)をKAとすると、
KA = [複合体]/([タンパク質]・[リガンド]n)
となります。このタンパク質が何個のリガンドを結合するか、すなわちnの値をスキャッチャードプロット(Scatchard plot)で求めることができます。さらに温度やpHなどの反応条件と組み合わせて、反応に関する自由エネルギー変化(ΔG)や活性化エネルギー(ΔE)などの熱力学的なパラメータを算出できます。
ラクトフェリンは非常に多様な物質と結合しますが、これらの結合には特異的な結合と、非特異的な結合とがあります。また、似通った物質に対する特異的な結合の場合は、群特異性(group-specific)の結合といいます。これらの親和性を利用してラクトフェリンの分離・精製を行っている例もあります。金属キレートアフィニティークロマトグラフィー(前章を参照)ヘパリンアフィニティークロマトグラフィー、色素アフィニティークロマトグラフィーなどです。特にヘパリンを用いた分離方法は簡便なため、ラクトフェリンの精製手段としてよく用いられます。
リガンドとの結合を測定する方法
リガンドとの結合を測定する方法は数多く開発されています。たとえば結合リガンドの数(n)、平衡定数(K)などの反応速度論的なパラメーター、さらにリガンド結合によって生じる構造変化や機能変化などを指標にする方法です。分子レベルの場合は、反応速度論や熱力学などに基づいた物理化学的な方法が主体ですが、細胞レベルではリガンドの結合によって誘起する生化学的な変化を指標として測定する方法もあります。また、非常に高価な機器を用いるものから、手近な試薬や装置で測定できるもの、低分子のあるいは高分子のリガンドの測定に適した方法などさまざまな手段が開発されています。
比較的簡便な測定方法は、図2-1に示した平衡透析法(equilibrium dialysis)です。半透膜を通過することのできる大きさの溶質分子が膜の内側に存在する高分子物質(ここではタンパク質)に結合すると、膜の内側の全濃度は外側よりも高くなり、膜内外のリガンド量を測定することによって結合量を求めることができます。なお、溶質が電荷をもつ場合は複雑な挙動(ドナン(Donnan)平衡)を示します。また、生体膜の場合には、能動輸送が生じることがあります。その他に、アフィニティクロマトグラフィー、分光学的方法(紫外部あるいは可視部での吸光度変化、円偏光二色性スペクトルの変化など)、電気泳動を用いる方法、流体力学的な方法、ゲルろ過法、電場中での分子の配向の変化を測定する方法、表面プラズモン共鳴測定法など枚挙に暇がありません(次章を参照)。
図2-1.平衡透析法(equilibrium dialysis)のモデル 透析膜(半透膜)の内部に○で示した高分子物質(タンパク質)を入れます。△は低分子物質(リガンド)を示します。
低分子物質との結合
Cibacron Blue F3GAは、ゲルろ過クロマトグラフィー用カラムの排除体積(void volume, Vo)を求めるために用いられているブルーデキストランに結合している青い色素です。ラクトフェリンをゲルろ過クロマトグラフィーで分離した際に、青く呈色して溶出したことがありました。これはブルーデキストランから遊離した色素がセファデックスゲルに残存し、それをラクトフェリンが結合して溶出したことが分かりました。それで、ラクトフェリンと色素の相互作用がどのようなものかを調べてみました。用いた方法は、色素のようにある波長で吸収を示す物質が結合することによって新たな吸収帯が観察される現象、すなわち誘起コットン効果(induced Cotton effect)を利用しました。実際には色素溶液をラクトフェリン溶液とさまざまな比率で混合し、生じたコットン効果を円偏光二色性(CD)スペクトル測定によって観察しました(図2-2)。その結果、ウシとヒトのラクトフェリンでは、この色素に対する結合性が異なることが分かりました。なお、この色素の構造はヌクレオチドに似ていると考えられ、このようなものを生体分子ミミックス(mimics)ということがあります。
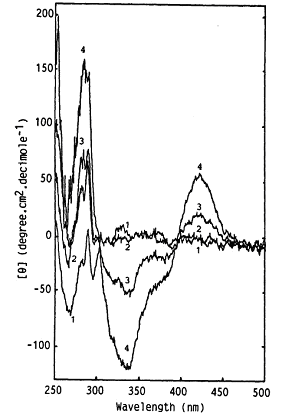
図2-2.の色素結合によって誘起されたヒトラクトフェリン(アポ型)CDスペクトル1)。1は色素の無い場合で4は添加量が最も多い場合。挿入図はアポ型の340 nm(○)と420 nm(●)、およびホロ型の290 nm(△)での変化の様子。鉄結合の有無で誘起される変化が異なっていることが分かる。また、ウシとヒトのラクトフェリンではスペクトルの形が全く違った。
リガンド結合の役割り
ラクトフェリンについては、リガンド結合と生体内における機能との関連がまだ十分には解明されていません。鉄イオン結合性については、周辺から鉄イオンを奪うことによって静菌作用を示したり、あるいは過酸化を防ぐ作用があると考えられています。しかし、鉄イオンを結合したホロラクトフェリンの方がアポ型よりもタンパク質分解酵素に対して抵抗性を示すことから、構造の安定性に寄与していることも確かです。これは、鉄イオンがラクトフェリンに結合したことによって、結合部位を形成しているドメインに構造変化が生じ(第1章を参照)、閉じた状態になるためと考えられます。カルシウムイオンもラクトフェリンの構造の安定性に寄与していると考えられている物質の一つです。なお、カルシウムイオンがタンパク質の立体構造の安定に寄与していることはαラクトアルブミンやリゾチームで詳しく研究されています2)。
これらリガンド結合によってタンパク質の構造の安定化やさらには構造変化が誘起される他に、リガンドを運搬するという働きも考えられます。ただし、ある物質を結合して運搬した後には、比較的に穏やかな条件で解離させることができなければラクトフェリンはリサイクルできません。たとえばトランスフェリンは鉄イオンを貯蔵所まで運び、体内での鉄イオンの調節に働いています。しかし、ラクトフェリンの場合はトランスフェリンよりも鉄イオンを強く結合する(第1章を参照)ため、トランスフェリンとは異なった作用をすると考えられます。また、血清アルブミンも血中で運搬体として働いており、脂肪酸、ビリルビン、ピリドキサール、銅イオン、ニッケルイオンなどを結合する部位を持っています3)。さらに、βラクトグロブリンはその疎水性のポケットにレチノールを結合します4)が、その機能はまだはっきりとは解明されていません。
リガンドの結合を細胞レベルにまで広げた場合には、細胞内の代謝系を亢進あるいは抑制する働きが期待されます。しかし、むしろラクトフェリン自体がリガンドとして働き、細胞表面のレセプターに結合するメカニズムが考えられます。たとえば後述するリンパ球表面や腸管上皮細胞に存在するラクトフェリンレセプターへの結合です。次章で述べるヘパリンやリポ多糖のラクトフェリンとの結合の場合も、その生体内での意義はほとんど推定の域をでていません。ラクトフェリンだけが標的細胞に結合した場合と、これらリガンドを結合したラクトフェリンが標的細胞に結合した場合とで、その後の作用が異なると考えられますが、詳細については多くの研究者が追究中です。
























