記事ID : 9506
チューブリンの多重修飾:グルタミル化とグリシル化 CYTOSKELETON NEWS 2012年7月号

チューブリンの多重修飾:グルタミル化とグリシル化
翻訳後修飾(PTM)は、アミノ酸残基に官能基を付加することでタンパク質の機能特性を改変する、高度に動的で、多くの場合は可逆的な現象です。細胞分化、増殖、運動性、細胞内トラフィッキングにおいて作用している主要な細胞骨格タンパク質である微小管(MT)はPTMの主な基質です。チューブリンのPTMは通常重合後、安定MTであるα/βチューブリンヘテロダイマー選択的に生じます1-3。その様なPTMは一つ以上のグルタミン酸かグリシン残基がそれぞれ付加する、ポリグルタミル化とポリグリシル化の2種です4-5。紡錘体、神経突起、中心小体/基底小体、軸糸を構成するMTはポリグルタミル化を受けます(図1)。逆に、ポリグリシル化は主に鞭毛や繊毛を後肢柄する細胞骨格構造である軸糸のMTで生じます(図2)。鞭毛は、生殖細胞を含めた細胞の表面から突出した特殊器官です。構造的に類似した繊毛は、表面から突出して細胞運動や流動の産生に関与し、外部刺激に応答します。最近、繊毛の異常な構成や機能が、繊毛関連疾患と称される広範囲のヒト遺伝性疾患と関連することが見出されています6。チューブリンのグルタミル化とグリシル化が繊毛の機能において重要な役割を果たすとすれば、多重修飾は無数のヒト疾患と関与することが予想されます。
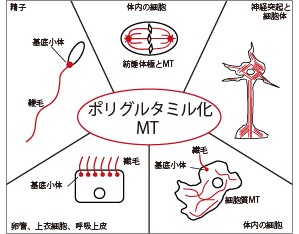
図1. 原生成物から哺乳類に至る細胞で見出されるポリグルタミル化微小管(MT)。MTは赤色で描写した。
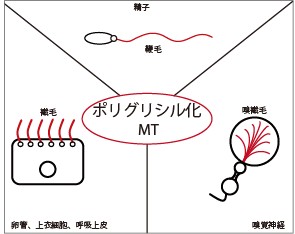
図2. 原生成物から哺乳類に至る細胞の繊毛や鞭毛で見出されるポリグリシル化微小管(MT)。MTは赤色で描写した。
最近まで、グルタミル化とグリシル化酵素の同定はチューブリン多重修飾に関連する謎の一種でした。現在では、その酵素がチューブリンチロシンリガーゼ様(TTLL)ファミリータンパク質の一員であることが判明しています7-11。特定のTTLLタンパク質は多重修飾の開始か伸長の段階に関与し、またチューブリンアイソフォームへの選択性を示します7-11。どちらの多重修飾も、α/βチューブリンのC-末端尾部でグルタミン酸残基のγ-カルボニル基に結合するペプチド側鎖に依存して多様化します。C-末端尾部は構造、運動MT-関連タンパク質(MAP)が結合する部位であり、PTMはその様な結合を調節することでMT機能の多様性をもたらしていることが予想されます。現に、最近のin vitro研究によって、特定MT集団の機能的な特性が調節されていることを意味する、チューブリンのポリグルタミル化が構造および運動MAPのMTへの結合を調節している可能性が示されました13-16。
ポリグルタミル化やポリグリシル化の潜在的機能に関する興味深い報告が幾何か、他にもなされています。ポリグルタミル化はin vivoとin vitroでMT切断を促進することが報告され、PTMがMTの大きさと安定性を調節するシグナルとして作用していることが示唆されました17。ポリグルタミル化はまた、神経突起身長に必要な局所MT切断により神経発達に作用することと17、神経のMTはほとんどが高度にポリグルタミル化されていることが明らかになっています2,4。繊毛や鞭毛の機能におけるグルタミル化やグリシル化の正確な作用は不明ですが、その様な修飾が正常の繊毛機能において必須であることは明らかです。気道上皮における繊毛軸糸MTのポリグルタミル化は、ダイニン活性に関与する正常な繊毛機能に必須です18,20。同様に、ポリグリシル化は繊毛と鞭毛の軸糸の集合と機能において必須です7。実際に、Drosophilaの精巣でTTLL3グリシル化酵素のRNAiノックダウンを行ったところ、オスの生存率減少と不妊に関連する、異常な精子尾部軸糸が生じました8。こうした最近のチューブリンの多重修飾に関する知見があるにもかかわらず、全チューブリン脱グルタミル化酵素や脱グリシル化酵素の同定を含め、多数の事象が未確認のままです21-23。
参考文献
1. Wloga D. and Gaertig J. (2010). J. Cell Sci. 123, 3447-3455.
2. Janke C. and Kneussel M. (2010). Trends Neurosci. 33, 362-372.
3. Hammond J., Cai D., and Verhey K.J. (2008). Curr. Opin. Cell Biol. 20, 71-76.
4. Edde B., Rossier J., Le Caer J.-P., Desbruyeres E., Gros F., et al. (1990). Science. 247, 83-85.
5. Redeker V., Levilliers N., Schmitter J.-M., Le Caer J.-P., Rossier J., et al. (1994). Science. 266, 1688-1691.
6. Waters A.M. and Beales P.L. (2011). Pediatr. Nephrol. 26, 1039-1056.
7. Wloga D., Webster D., Rogowski K., Bre M.H., Levilliers N., et al. (2009). Dev. Cell. 16, 867-876.
8. Rogowski K., Juge F., van Dijk J., Wloga D., Strub J.-M., et al. (2009). Cell. 137, 1076-1087.
9. Janke C., Rogowski K., Wloga D., Regnard C., Kajava A.V., et al. (2005). Science. 308, 1758-1762.
10. van Dijk J., Rogowski K., Miro B., Lacroix B., Eddie B., et al. (2007). Mol. Cell. 26, 437-448.
11. Wloga D., Rogowski K., Sharma N., Dijk J.V. Janke C. et al. (2008). Eukaryotic Cell. 7, 1362-1372.
12. Nogales E. (2000). Annu. Rev. Biochem. 69, 277-302.
13. Boucher D., Larcher J.C., Gros F., and Denoulet P. (1994). Biochemistry. 33, 12471-12477.
14. Bonnet C., Boucher D., Lazereg S., Pedrotti B., Islam K., et al. (2001). J. Biol. Chem. 276, 12839-12848.
15. Larcher J.C., Boucher D., Lazereg S., Gros F., and Denoulet P. (1996). J. Biol. Chem. 271, 22117-22124.
16. Ikegami K., Heier R.L., Taruishi M., Takagi H., Mukai M., et al. (2007). Proc. Natl. Acad. Sci. U.S.A. 104, 3213-3218.
17. Lacroix B., Dijk J.v., Gold N.D., Guizetti J., Aldrian-Herrada G., et al. (2010). J. Cell Biol. 189, 945-954.
18. Ikegami K., Sato S., Nakamura K., Ostrowski L.E., and Setou M. (2010). Proc. Natl. Acad. Sci. U.S.A. 107, 10490-10495.
19. Wloga D., Dave D., Meagley J., Rogowski K., Jerka-Dziadosz M., et al. (2010). Eukaryotic Cell. 9, 184-193.
20. Suryavanshi S., Edde B., Fox L.A., Guerrero S., Hard R., et al. (2010). Curr. Biol. 20, 435-440.
21. O’Hagan R., Piasecki B.P., Silva M., Phirke P., Nguyen K.C., et al. (2011). Curr. Biol. 21, 1685-1694.
22. Lalle M., Camerini S., Cecchetti S., Fantauzzi C.B., Crescenzi M., et al. (2011). J. Biol. Chem. 286, 4471-4484.
23. Kimura Y., Kurabe N., Ikegami K., Tsutsumi K., Konishi Y., et al. (2010). J. Biol. Chem. 285, 22936-22941.
未標識タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-A | 1*1 MG |
¥41,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-B | 5*1 MG |
¥189,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-C | 20*1 MG |
お問い合わせ |
Tubulin (porcine brain, >99% pure) |
CYT | T240-DX | 1*10 MG |
¥291,000 |
Tubulin: MAP-rich (porcine) |
CYT | ML116-A | 1*1 MG |
¥35,000 |
Tubulin: MAP-rich (porcine), Porcine |
CYT | ML116-B | 5*1 MG |
¥169,000 |
Tubulin: MAP-rich (porcine) |
CYT | ML116-DX | 1*10 MG |
¥294,000 |
Tubulin (HTS format), Porcine |
CYT | HTS03-A | 1*4 MG [8 assays] |
CYT社 HTS03A 2*4 を参照 |
Tubulin (HTS format), Porcine |
CYT | HTS03-B | 1*40 MG [96 assays] |
お問い合わせ |
Tubulin, frozen liquid, Porcine |
CYT | T238P-A | 1*1 MG |
¥55,000 |
Tubulin, frozen liquid, Porcine |
CYT | T238P-B | 5*1 MG |
¥209,000 |
Tubulin, frozen liquid, Porcine |
CYT | T238P-C | 20*1 MG |
お問い合わせ |
アッセイキット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥298,000 |
Tubulin Polymerization Assay Kit, Porcine |
CYT | BK004P | 1 KIT [24 assays] |
¥209,000 |
Tubulin Polymerization Assay |
CYT | BK011P | 1 KIT [96 assays] |
¥302,000 |
抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Tubulin, Trial size (Sheep)  |
CYT | ATN02-S | 1*25 UL |
¥40,000 |
Anti Tubulin (Sheep)  |
CYT | ATN02 | 2*100 UL |
¥106,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













