β-カテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御 CYTOSKELETON NEWS 2018年3月号

β-カテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
タンパク質の翻訳後修飾 (PTM) には、リン酸化、アセチル化、ユビキチン化、SUMO化などがあり、一つのタンパク質が多数の機能を持つよう進化しており、プロテオームの増大した複雑さと、機能の多様性を生み出しています1。PTMによる複雑でダイナミックな制御力の主な例としてWnt/β-カテニンシグナル伝達が挙げられます2,3。本経路は、胚発生や成体細胞が恒常性を保っている間に、細胞増殖、分化、遊走を制御します4-6。さらに、Wnt/β-カテニンシグナル伝達の調節不全は、発がんや変性疾患を初めとする複数の病態と関係づけられています5,7。標準的なWnt媒介性シグナル伝達では、β-カテニンが主要な役割を果たし、同時転写因子としてDNA結合タンパク質であるTCF(T細胞因子)やLEF-1(リンパ球エンハンサー因子1)と相互作用し、cyclin D1, c-jun, c-mycなどのWnt/β-カテニン標的遺伝子の転写を活性化します8-11(図1)。本稿では、β-カテニンとTCF/LEF-1のPTMによる機能制御について述べていきます。
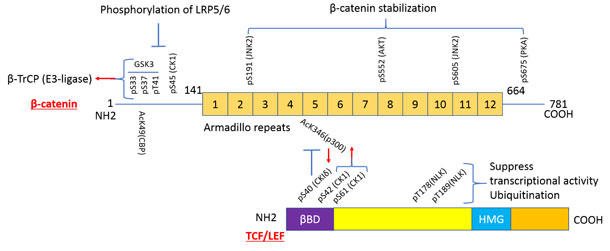
図1. β-カテニンとTCF/LEF-1のPTMによる安定性と相互作用の制御
(βBD:β-カテニン結合ドメイン、HMG:高運動基)
Wntシグナル伝達におけるβ-カテニンの翻訳後制御
Frizzled (Fz)と低密度リポタンパク質受容体関連タンパク質 (LRP) 5や6の共受容体複合体へ、Wntが結合していない場合、足場材料/主要抑制タンパク質であるアキシンやAPCタンパク質から構成されるマルチタンパク質破壊複合体や、セリン/スレオニンキナーゼカゼインキナーゼ1α(CK-1α) およびグリコーゲン合成酵素キナーゼ3(GSK3)が、β-カテニンのリン酸化を媒介します2,3,9。このような静止状態の条件下では、β-カテニンは次々にリン酸化され、まずSer45がCK-1αによりリン酸化され、その後GSK3によりSer33, Ser37, Thr41がリン酸化されます12(図1)。リン酸化を受けて、E3ユビキチンリガーゼであるβ-トランスデューシン反復配列含有タンパク質(β-TrCP)が、リン酸化β-カテニンのLys19とLys49をユビキチン化し13,14、これによりプロテアソーム分解が生じてβ-カテニンレベルと活性の低下が誘導されます15,16。反対に、Wnt結合が生じると、足場タンパク質のディシェベルド (Dvl)がFz-LRP5/6共受容体複合体へと補充され、破壊複合体を阻害する一連の分子シグナルを活性化して、リン酸化されていない細胞質ゾルのβ-カテニンとβ-カテニン依存性転写が安定化されます2,3,17-19。CK-1αとGSK3の部分的阻害18、β-TrCPの阻害20、LRP6の細胞内ドメインに存在する5つの高度に保存されたPPPSPモチーフのリン酸化21,22(図1)と、続いて起こるこれらWntシグナル伝達タンパク質の凝集によって安定化されます。Wntの負の制御因子であるアキシンは、この凝集複合体へ運ばれ、直接結合して阻害されます3,17。特筆すべきは、同一のPTMが修飾残基に応じてβ-カテニン活性を阻害したり促進したりすることができることです。たとえば、Lys394のユビキチン化によりβ-カテニンは安定化されます17。同様に、それぞれPKAによるSer675、AKTによるSer552、およびJNK2によるSer119/605のリン酸化によりβ-カテニンが安定化されます23-25(図1)。アセチルトランスフェラーゼは複数のLys残基に作用しますが、それぞれのアセチル化により異なった方法でβ-カテニンの機能の役割や安定性が調節されます。たとえば、CBPによるLys49のアセチル化によりβ-カテニンの転写活性が阻害され26、p300によるLys345のアセチル化によりβ-カテニンとTCFの相互作用が促進され27、PCAFによるLys19とLys49のアセチル化によりβ-カテニンの安定性が上昇します28。興味深いことに、チロシンリン酸化はβ-カテニン活性を促進するだけのようです17。
Wntシグナル伝達におけるTFC/LEF-1の翻訳後修飾
TCFとLEF-1は、CtBP、HBP1、β-カテニンといった補助因子と共に多量体の転写複合体を形成し、共に機能して遺伝子発現を抑制または活性化します29,30。TCF/LEF-1と共調節因子間の結合親和性は各タンパク質のそれぞれのPTM状態に著しく影響を受けます(図1)。TCFは複数のThr/Ser残基においてリン酸化されますが、それぞれ対抗する機能効果を示します。たとえば、TNKキナーゼによるTCFのSer154におけるリン酸化は自身の転写活性に必要ですが3、Nemo様キナーゼ (NLK) によるThr178やThr189のリン酸化ではTCF/DNA結合が阻害され自身の転写活性が抑制されます31。NLKによるTCFのリン酸化はTCFのユビキチン化にも関連付けられています。LEF-1はNLKによるThr155とSer166がリン酸化され、これによりTCF/LEF-1/ β-カテニン複合体のDNA結合が阻害されます3。逆に、CK-1によるSer42とSer61のリン酸化によりβ-カテニン結合とトランス活性化が促進されます32。E3リガーゼであるMLK関連リングフィンガータンパク質(NARF) は、in vitroとin vivoにおいてTCF/LEF-1をユビキチン化し、これによりTCF/LEF-1分解へと誘導されます33。TCFとLEF-1は何れもPIASyによるSUMO化を経ますが、機能的な結果は大きく異なります。TCFのLys297におけるSUMO化により活性促進が得られ34、一方でLEF-1のLys25とLys267残基におけるSUMO化では活性の失活が生じます35。
まとめ
全てではないとしてもほとんどのタンパク質と同様に、Wntシグナル伝達因子であるβ-カテニンやその共転写制御因子であるTCFやLEF-1は複数のPTMにより制御されています。さらに、同一のPTMでも修飾される残基が異なる場合、活性が促進されたり阻害されたりします。その上、PTMは共同的であったり相互排他的であったりします。このような細胞のプロテオームにおける複雑で多様な機能制御を研究するためには、高い精度の定量的な試薬が必要となります。Cytoskeleton社では、PTMがどのようにタンパク質局在化と機能を制御しているか見識を深めるために、内在性タンパク質のチロシンリン酸化、ユビキチン化、SUMO化、アセチル化を測定できるSignal Seeker™タンパク質濃縮キットをご用意しております。
- Prabakaran S. et al. 2012. Post-translational modification: nature's escape from genetic imprisonment and the basis for dynamic information encoding. Wiley Interdiscip. Rev. Syst. Biol. Med.4, 565-583.
- Niehrs C. 2012. The complex world of WNT receptor signalling. Nat. Rev. Mol. Cell Biol. 13,767-779.
- Gao C. et al. 2014. Regulation of Wnt/beta-catenin signaling by posttranslational modifications. Cell Biosci. 4, 13.
- Wodarz A. and Nusse R. 1998. Mechanisms of Wnt signaling in development. Annu. Rev. Cell Dev. Biol. 14, 59-88.
- Polakis P. 2000. Wnt signaling and cancer. Genes Dev. 14, 1837-1851.
- McCrea P.D. and Gottardi C.J. 2016. Beyond beta-catenin: prospects for a larger catenin network in the nucleus. Nat. Rev. Mol. Cell Biol. 17, 55-64.
- Nusse R. and Clevers H. 2017. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities. Cell. 169, 985-999.
- MacDonald B.T. et al. 2009. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Dev. Cell. 17, 9-26.
- Cong F. et al. 2004. Wnt signals across the plasma membrane to activate the beta-catenin pathway by forming oligomers containing its receptors, Frizzled and LRP. Development. 131, 5103-5115.
- Li V.S. et al. 2012. Wnt signaling through inhibition of beta-catenin degradation in an intact Axin1 complex. Cell. 149, 1245-1256.
- Ziegler S. et al. 2005. Novel target genes of the Wnt pathway and statistical insights into Wnt target promoter regulation. FEBS J. 272, 1600-1615.
- Liu C. et al. 2002. Control of beta-catenin phosphorylation/degradation by a dual-kinase mechanism. Cell. 108, 837-847.
- Wu G. et al. 2003. Structure of a β-TrCP1-Skp1-β-catenin complex: destruction motif binding and lysine specificity of the SCF βTrCP1 ubiquitin ligase. Mol. Cell. 11, 1445-1456.
- Winer I.S. et al. 2006. Lysine residues Lys-19 and Lys-49 of β-catenin regulate its levels and function in T cell factor transcriptional activation and neoplastic transformation. J. Biol. Chem. 281, 26181-26187.
- Aberle H. et al. 1997. Beta-catenin is a target for the ubiquitin-proteasome pathway. EMBO J. 16, 3797-3804.
- Hart M. et al. 1999. The F-box protein beta-TrCP associates with phosphorylated beta-catenin and regulates its activity in the cell. Curr. Biol. 9, 207-210.
- Valenta T. et al. 2012. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736.
- Hernandez A.R. et al. 2012. Kinetic responses of beta-catenin specify the sites of Wnt control. Science. 338, 1337-1340.
- Kim S.E. et al. 2013. Wnt stabilization of beta-catenin reveals principles for morphogen receptor-scaffold assemblies. Science. 340, 867-870.
- Li V.S.W. et al. 2012. Wnt signaling through inhibition of β-catenin degradation in an intact Axin1 complex. Cell. 149, 1245-1256.
- MacDonald B.T. et al. 2008. Wnt signal amplification via activity, cooperativity, and regulation of multiple intracellular PPPSP motifs in the Wnt co-receptor LRP6. J. Biol. Chem. 283, 16115-16123.
- Niehrs C. and Shen J. 2010. Regulation of Lrp6 phosphorylation. Cell Mol. Life Sci. 67, 2551-2562.
- Hino S. et al. 2005. Phosphorylation of beta-catenin by cyclic AMP-dependent protein kinase stabilizes beta-catenin through inhibition of its ubiquitination. Mol. Cell Biol. 25, 9063-9072.
- Fang D. et al. 2007. Phosphorylation of beta-catenin by AKT promotes beta-catenin transcriptional activity. J. Biol. Chem. 282, 11221-11229.
- Wu X. et al. 2008. Rac1 activation controls nuclear localization of beta-catenin during canonical Wnt signaling. Cell. 133, 340-353.
- Wolf D. et al. 2002. Acetylation of beta-catenin by CREB-binding protein (CBP). J. Biol. Chem. 277, 25562-25567.
- Levy L. et al. 2004. Acetylation of beta-catenin by p300 regulates beta-catenin-Tcf4 interaction. Mol. Cell Biol. 24, 3404-3414.
- Ge X. et al. 2009. PCAF acetylates {beta}-catenin and improves its stability. Mol. Biol. Cell. 20, 419-427.
- Cadigan K.M. and Waterman M.L. 2012. TCF/LEFs and Wnt signaling in the nucleus. Cold Spring Harb. Perspect. Biol. 4, a007906.
- Hurlstone A. and Clevers H. 2002. T-cell factors: turn-ons and turn-offs. EMBO J. 21, 2303-2311.
- Ishitani T. et al. 1999. The TAK1-NLK-MAPK-related pathway antagonizes signalling between beta-catenin and transcription factor TCF. Nature. 399, 798-802.
- S. Wang S. and Jones K.A. 2006. CK2 controls the recruitment of Wnt regulators to target genes in vivo. Curr. Biol. 16, 2239-2244.
- Yamada M. et al. 2006. NARF, an nemo-like kinase (NLK)-associated ring finger protein regulates the ubiquitylation and degradation of T cell factor/lymphoid enhancer factor (TCF/LEF). J. Biol. Chem. 281, 20749-20760.
- Yamamoto H. et al. 2003. Sumoylation is involved in beta-catenin-dependent activation of Tcf-4. EMBO J. 22, 2047-2059.
- Sachdev S. et al. 2001. PIASy, a nuclear matrix-associated SUMO E3 ligase, represses LEF1 activity by sequestration into nuclear bodies. Genes Dev. 15, 3088-3103.
Signal Seeker™タンパク質濃縮キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
¥239,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













