記事ID : 11797
モノユビキチン化:タンパク質調節のダイナミックなタグ CYTOSKELETON NEWS 2013年9月号

モノユビキチン化:タンパク質調節のダイナミックなタグ
ユビキチン化は、ターゲットタンパク質の1つ又はそれ以上のリジンに8kDaのユビキチン(Ub)ペプチドが共有結合により付着する翻訳後修飾(PTM;post-translational modification)です。ターゲットタンパク質は、1つのリジンに対して1つのユビキチンが結合するモノユビキチン化、多数のリジンに1つのユビキチンが結合するマルチユビキチン化、最初にタンパク質のリジンに結合したユビキチンが連続してユビキチン化されてユビキチン鎖となるポリユビキチン化、として修飾を受けます。ユビキチンが7つのリジンを含んでおり、そのいずれに対してもポリユビキチン化が起こりうることが証明されていることから、このPTMによりターゲットタンパク質が多様な修飾を受ける可能性が示唆されています1。また、ユビキチン化は、脱ユビキチン化タンパク質(DUB;deubiquitinating protein)の作用により、迅速な可逆的なプロセスである2ことも知られており、リン酸化のような既によく研究されたPTMよりも更に複雑で、非常に多目的なシグナルリング修飾である可能性が考えられています。ターゲットタンパク質のプロテオソーム分解におけるユビキチン化の重要な役割はよく知られている3一方で、ユビキチンの分解以外の役割は、説明が始まったばかりです。本稿では、モノユビキチン化によって調節される、一般的な非分解のプロセスにフォーカスします(図1)。
分子内自己抑制
リン酸化のようなPTMは、タンパク質の自己抑制の主要なレギュレーターです4。タンパク質のモノユビキチン化が同様の機能を持っているという証拠が明らかになりつつあります。いくつかの報告により、ユビキチン結合ドメイン(UBD;ubiquitin binding domain)を持つタンパク質が高い頻度でモノユビキチン化(mUb)されていることがわかり、これにより、分子内UBD-mUb相互作用による単純な自己抑制機構が提案されています5,6。エンドサイトーシスアダプタータンパク質(Sts1、Sts2、Eps15など)がこのタイプの調節の良い例です6,7。上皮増殖因子受容体(EGFR)のような受容体が、ユビキチン化されて活性化し、内部移行とエンドソームリソソーム経路による分解を引き起こし、これにより伝達シグナルが弱まります。エンドサイトーシスアダプタータンパク質は、ユビキチン化された細胞表面レセプターのUb基とUBDを通して結合し、レセプターをエンドソーム輸送タンパク質と結合させることにより、内部移行及び分解を調節します。アダプタータンパク質が自己抑制される場合は、それによりユビキチン化されたターゲット受容体の認識がブロックされ、伝達経路は伝達を続けることになります。これらのケースでは、自己抑制は受容体媒介シグナル伝達のモジュレーターとして機能しています7(図1)。
UBDには20種類のファミリーがあり、1つまたはそれ以上のUBDを含むタンパク質が150種類以上知られています8。UBDタンパク質は、エンドサイトーシス、DNA修復、転写調節、シグナル伝達などの幅広い細胞プロセスに関与しています6。ユビキチンが媒介する自己抑制が、これらのプロセスの調節において重要な役割を果たしていることを示唆する証拠が発見されています。
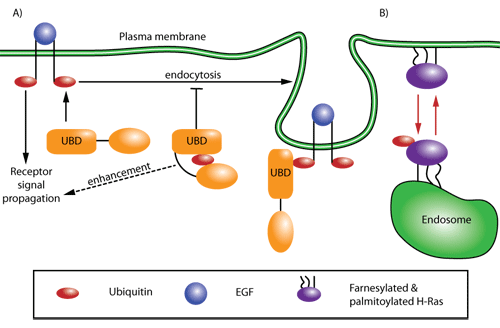
図1 ユビキチンが媒介するシグナリング及び輸送の模式図
(A)黒い矢印で示す経路は、ユビキチンによる自動抑制を示します。UBDを含むタンパク質の自己抑制は、受容体のエンドサイトーシスとシグナル伝達を調節します(例:EGFR リサイクリング7)。
(B)赤い矢印で示す経路は、ユビキチンが調節するタンパク質の細胞局在化を示します。この種の調節はH-及びN-Rasで起こっており、ユビキチン化によりRasは細胞膜からエンドソーム膜へ移行します13。
細胞内局在化及び輸送
タンパク質の細胞内における適切な局在化は、その活性を調節する主要な手段であり、十分に裏づけられたPTM事象(ファルネシル化、パルミチル化、リン酸化など)を含む空間的調節の忠実性を確保するために、多くのストラテジーが発展してきました10-12。モノユビキチン化は、他のPTMと共に機能し、ある種のタンパク質(低分子GTPase、細胞骨格タンパク質、スキャフォールドタンパク質など)を特異的な細胞区画に局在化させることができます(図1)。例えば、H-Ras、N-Ras、K-Rasアイソフォームは、モノユビキチン化の基質であることがわかっています(H-Ras及びN-Rasのジユビキチン化は非分解の修飾)13,14。H-Rasのユビキチン化は、ファルネシル化及びパルミチル化と合わせてH-Rasを細胞膜からエンドソーム部へ再配置させる(これに伴いMAPKシグナリングが低下)機能を持っているようです13。興味深いことに、K-Ras(最も癌との関わりが強いRas遺伝子)のモノユビキチン化は、K-Rasと下流のエフェクターとの親和性を調節することで、GTPの受け取りを強化しているようです15。同様に、VEGF応答シグナリングもモノユビキチン化と関わっています。アクチン結合タンパク質フィラミンBのモノユビキチン化フォームは、VEGFに応答して核/細胞質輸送及びHDAC7の細胞質局在化を調節することが示されました16。VEGFの刺激に応答して、フィラミンBが一時的にモノユビキチン化され、HDAC7の核局在化シグナル(NLS;nuclear localization signal)に結合します。これにより、HDAC7の核内への再移行が阻害され、VEGF応答に必要とされる遺伝子に対するHDAC7の転写抑制活性が弱まります16。モノユビキチン化のターゲットとされる、構造的関連のあるタンパク質に、Toll-like及びインターロイキン-1レセプター複合体のスキャフォールドタンパク質TRAF4があります。このタンパク質は、密着接合(Rac1の活性化及び正常の胸部上皮細胞及び癌細胞の移動に必要な部位)への局在化の必要条件としてモノユビキチン化を受けます17。
タンパク質複合体形成の調節
モノユビキチン化は、多くの系において、タンパク質の複合体形成を調節していることが報告されています18,19。例えば、転写伸長のプロセスには、RNAポリメラーゼから物理的なブロックを除去するために、ヌクレオソームの再構成が必要なことが知られています。FACT(facilitates chromatin transcription)複合体は、このプロセスで重要な役割を果たし、ヌクレオソームからヒストンH2A/H2Bダイマーを転置させることによって機能しています。In Vitroにおける再構築システムで、H2Bのモノユビキチン化がFACTが媒介するH2A/H2Bダイマーの転置に必要であることが証明されました18。
モノユビキチン化及び非分解の一般的なユビキチン化シグナルは、多目的な調節モチーフとして、急速に確立されつつあります
参考文献
1) Sadowski, M. et al. 2012. Protein monoubiquitination and polyubiquitination generate structural diversity to control distinct biological processes. IUBMB Life. 64:136-142.
2) Burrows, J. et al. 2012. Regulation of cellular responses by deubiquitinating enzymes: an update. Frontiers Biosci. 17:1184-1200.
3) Chitra, S. et al. 2012. The ubiquitin proteasome system and efficacy of proteasome inhibitors in diseases. Int. J. Rheum. Dis. 15:249-260.
4) Betschinger, J. et al. 2005. Phosphorylation-induced autoinhibition regulates the cytoskeletal protein lethal (2) giant larvae. Cell. 15:276-282.
5) Hicke, L. et al. 2005. Ubiquitin binding domains. Nature Rev. Mol. Cell Biol. 6: 610-621.
6) Holler, D. et al. 2006. Regulation of ubiquitin binding proteins by monoubiquitination. Nature Cell Biol. 8:163-169.
7) Fallon, L. et al. 2006. A regulated interaction with the UIM protein Eps15 implicates parkin in EGF receptor trafficking and PI(3)K-Akt signalling. Nat. Cell Biol. 8:834-842.
8) Dikic, I. et al. 2009. Ubiquitin-binding domains: from structures to functions. Nature Rev. Mol. Cell Bio. 10:659-671.
9) Nabi, I.R. (Ed). 2011. Cellular Domains. Wiley-Blackwell Press: Hoboken, NJ.
10) Basso, A. et al. 2005. Thematic review: lipid posttranslational modifications. Farnesyl transferase inhibitors. J. Lipid Res. 47:15-31.
11) Salaun, C. et al. 2010. The intracellular dynamic of protein palmitoylation. J. Cell Biol. 191:1229-1238.
12) York, B. et al. 2006. Tuberin nuclear localization can be regulated by phosphorylation of its carboxyl terminus. Mol. Cancer Res. 4:885-897.
13) Jura N. et al. 2006. Differential modification of Ras proteins by ubiquitination. Mol. Cell. 21:679-687.
14) Ahearn I., et al. 2012. Regulating the regulator: post-translational modification of Ras. Nature Rev. 13:39-51.
15) Sasaki, A. et al. 2012. Ubiquitination of Ras enhances activation and facilitates binding to select downstream effectors. Sci. Signal. 4:ra13.
16) Su, Y. et al. 2013. Monoubiquitination of filamin B regulates vascular endothelial growth factor-mediated trafficking of histone deacetylase 7. Mol. Cell Biol. 33:1546-1560.
17) Wang X. et al. 2013. Ubiquitination of tumor necrosis factor receptorassociated factor 4 (TRAF4) by SMAD ubiquitination regulatory factor 1 (Smurf1) regulates motility of breast epithelial and cancer cells. J. Biol. Chem. 288:21784-21792.
18) Pavri, R. et al. 2006. Histone H2B monoubiquitination functions cooperatively with FACT to regulate elongation by RNA polymerase II. Cell. 125:703-717.
19) Bienko, M. et al. 2010. Regulation of translesion synthesis DNA polymerase eta by monoubiquitination. Cell. 37:396-407.
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008-S | 1 KIT [20 assays] |
¥124,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
Rac and Cdc42 Activator, Mouse |
CYT | CN02-A | 5*10 UNIT |
¥71,000 |
Rac and Cdc42 Activator |
CYT | CN02-B | 20*10 UNIT |
¥254,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













