記事ID : 33768
RhoファミリーGEFと樹状突起スパインの構造的可塑性 CYTOSKELETON NEWS 2018年4月号

RhoファミリーGEFと樹状突起スパインの構造的可塑性
樹状突起スパインは、最も興奮性の高いグルタミン酸性シナプスにおけるシナプス後成分であり、シナプス機能調節におけるシナプス構造的可塑性1-4の主要部位です3。スパインにおける活性に依存した構造的可塑性は(例えばスパイン形態形成)は、スパインの主要構成成分であるF-アクチンの動的な再構成に依存します1-7。スパイン形態形成は、正常な学習や記憶、および神経変性疾患や神経障害の発生において重要な意味があります8-10。
RhoA、Rac1、Cdc42などのGTPアーゼがスパイン形態形成を制御します。RhoAがスパイン成長や安定性を阻害するのに対し、Rac1やCdc42は反対の効果を発揮します。実際には、Rhoファミリーによるスパイン構造的可塑性の制御は、もっと複雑です5,7,11-16。グアニン交換因子(GEF)によってGTP/GDP交換が引き起こされ、GTPアーゼ活性化タンパク質(GAP)が本来持つ活性が刺激されることで、Rho GTPアーゼが精密に空間的時間的に制御されます。少なくとも8種類のRhoファミリーGEFがスパイン形成を制御し、これらGEFがNMDA型グルタミン酸受容体(NMDAR)や受容体チロシンキナーゼ(RTK)を始めとする様々な受容体シグナル伝達経路を介して活性化されます5-7。NMDARはカルシウム流入と、その後のカルシウム/カルモジュリン依存性キナーゼ(CaMK)の活性化を媒介し、これによりGEF活性に必須なRhoファミリーGEFのリン酸化が生じます5,7,17,18。本稿では、RhoファミリーGEFのKalirin7 (Kal7: 成体脳で最も豊富に存在するアイソフォーム)、Trio-9 (海馬で最も豊富に存在するアイソフォーム)、Tiam1、RasGRF2、DOCK10、DOCK180、ephrexin1、ephrexin5によるスパイン構造可塑性の制御について討論します(図1)。
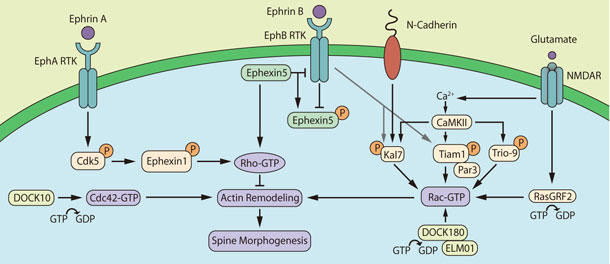
図1. RhoファミリーGEFによる樹状突起スパイン構造可塑性の制御
RacとCdc42 GEF
Rac GEF Kal7は、成熟した海馬や皮質性ニューロンのスパインにおいて高発現しています。Kal7はシナプス可塑性において最も研究された形態であり、おそらく学習や記憶の細胞レベルでの基盤であるNMDAR依存性長期増強 (LTP) に必須です19,20。カルシウム活性型CaMKIIはKal7のThr95残基をリン酸化し、これによりKal7媒介性のRac1活性化と活動依存的なスパイン形態形成に必要なアクチン細胞骨格の再編成が可能となります17,18,21,22。in vitroとin vivoにおいて、Kal7活性上昇によりスパインの密度と大きさが増大しますが、一方、Kal7はスパインの密度を下げるよう下方制御しています17,18,21-24。同様に、KalirinパラログのGEF Trio-9はCaMKIIによりリン酸化され、Kal7と同様の様式で海馬ニューロンにおけるNMDAR依存性LTPを制御し、おそらく同時にスパイン構造の可塑性を制御します18。さらに、Kal7活性は、シナプス経由の接着分子の類であるN-カドヘリン誘導性のスパイン形態形成に必須です5, 22(図1)。
Rac GEF Tiam1は、発生過程の小脳や海馬において高発現し、このタンパク質もCaMKII媒介型のリン酸化を経てRac1の活性化を行います17, 25。Tiam1機能を選択的に遮断すると、スパイン密度が低減し、NMDAR依存性の新規スパイン形成が阻害される反面、Tiam1を過剰発現するとスパイン密度が増大します5, 25。興味深いことに、Tiam1誘導性Rac活性化、その後のスパイン形態形成、およびTiam1のスパインへの限定された局在化は、極性タンパク質PAR-3 (partitioning-defective gene 3)26により制御されています(図1)。
アクチンに基づくスパイン可塑性を制御する他のRac GEFには、RasGRF2とDOCK180があります。RasGRF2は、NMDAR依存性LTPと、関連する迅速なスパイン拡大に必須です27。同様に、ELMO1とともに必須複合体に属するDOCK180もまた、ニューロンにおけるRac GTPアーゼの活性化を介してスパイン形態形成を正に制御します。DOCK180の欠損によりスパイン頭部の大きさに影響を与えることなくスパイン密度が減少し、一方で過剰発現により密度が高くなります28(図1)。
Rac GEFもまた、EphB RTK活性化後にリン酸化されます5-7,17,22,29(図1)。Kal7はEphB媒介型スパイン密度増大に必要であり30、Kal7のリン酸化はEphBまたは関連キナーゼの何れかに媒介される可能性があります。特筆すべき候補としてサイクリン依存性キナーゼ5(Cdk5)があり、これがKal7のThr1590をリン酸化し、Kal7によるスパイン形態形成制御に影響を及ぼします31。Kal7と同様に、Tiam1もEphB媒介型スパイン密度増大に必要であり、これもEphBまたは関連キナーゼの何れかによってTyr829がリン酸化され活性化します32。EphB RTKは、Tiam1とRac GAP Bcrの協調活動も制御し、これらは空間的に制御されたスパイン形態形成のEphB RTK媒介型制御に必須となる複合体を形成します33。DOCK10はCdc42/Rac1 GEFであるものの、このタンパク質がCdc42の活性化を行うことで、これを介して小脳や海馬ニューロンのスパイン数や頭部の大きさが正に制御されます34(図1)。
Rho GEF
スパイン可塑性を上方制御するRacやCdc42 GEFとは反対に、Rho GEFは逆の効果を発揮します。例えば、GEF-H1(ARHGEF2またはLfcとしても知られる)はスパイン密度と長さを負に制御します35。Ephexin1のSrcキナーゼ媒介型Try87残基のリン酸化とCdk5媒介型Thr41とSer139残基のリン酸化によりRTK EphA4、Cdk5、およびRho GEF ephexin1が連続的に活性化された後、活性化されたRhoAが海馬ニューロンにおけるスパイン退縮を誘導します29(図1)。その他のRho GEFであるephexin5もまた、RhoA活性化を介してスパイン退縮を誘導します。Ephexin5は直接結合することでEphB媒介性スパイン形態形成を阻害しますが、RhoAを活性化します。EphBのリガンド誘導性活性化を受けて、RTKはチロシンリン酸化(Tyr361)によりephexin5を不活性化し、これによりユビキチン媒介型分解が誘導されます。EphBは脱抑制を受けてスパイン形態形成を正に制御します36(図1)。
まとめ
樹状突起スパインは、最も興奮性が高い神経伝達におけるシナプス後成分であり、シナプスの構造的可塑性部位です。スパインの構造的可塑性はアクチン細胞骨格の再編成に依存し、これはRhoファミリーGTPアーゼのGEF媒介型活性化により制御されています。したがって、ニューロンにおいてどのようにGEFが機能するのか、また、時間空間的に精密に制御をするために、異なるGEFによりどのように同一GTPアーゼがコントロールされているのかより理解する必要があります。Cytoskeleton社では、これらの研究に役に立つ生細胞イメージングプローブ (SiRシリーズ、SiR700シリーズ)や複数の精製GEFやGTPアーゼ、ならびに活性化や交換アッセイ、活性化因子や阻害因子をご提供しています。
参考文献
- Matus A. 2000. Actin-based plasticity in dendritic spines. Science. 290, 754-758.
- Carlisle H.J. and Kennedy M.B. 2005. Spine architecture and synaptic plasticity. Trends Neurosci. 28, 182-187.
- Kasai H. et al. 2003. Structure-stability-function relationships of dendritic spines. Trends Neurosci. 26, 360-368.
- Matsuzaki M. et al. 2004. Structural basis of long-term potentiation in single dendritic spines. Nature. 429, 761-766.
- Tolias K.F. et al. 2011. Control of synapse development and plasticity by Rho GTPase regulatory proteins. Prog. Neurobiol. 94, 133-148.
- Hedrick N.G. and Yasuda R. 2017. Regulation of Rho GTPase proteins during spine structural plasticity for the control of local dendritic plasticity. Curr. Opin. Neurobiol. 45, 193-201.
- Woolfrey K.M. and Srivastava D.P. 2016. Control of dendritic spine morphological and functional plasticity by small GTPases. Neural Plasticity. 2016, 3025948. DOI: 10.1155/2016/3025948.
- Dierssen M. and Ramakers G.J. 2006. Dendritic pathology in mental retardation: from molecular genetics to neurobiology. Genes Brain Behav. 5 (Suppl. 2), 48-60.
- Penzes P. and Van Leeuwen J.E. 2011. Impaired regulation of synaptic actin cytoskeleton in Alzheimer's disease. Brain Res. Rev. 67, 184-192.
- Penzes P. et al. 2011. Dendritic spine pathology in neuropsychiatric disorders. Nat. Neurosci. 14, 285-292.
- Tashiro A. and R. Yuste. 2004. Regulation of dendritic spine motility and stability by Rac1 and Rho kinase: evidence for two forms of spine motility. Mol. Cell. Neurosci. 26, 429-440.
- Rex C.S. et al. 2009. Different Rho GTPase-dependent signaling pathways initiate sequential steps in the consolidation of long-term potentiation. J. Cell Biol. 186, 85-97.
- Hodges J.L. et al. 2011. Myosin IIb activity and phosphorylation status determines dendritic spine and post-synaptic density morphology. PLoS ONE.6, e24149.
- Murakoshi H. et al. 2011. Local, persistent activation of Rho GTPases during plasticity of single dendritic spines. Nature. 472, 100-104.
- Newell-Litwa K. et al. 2015. ROCK1 and 2 differentially regulate actomyosin organization to drive cell and synaptic polarity. J. Cell Biol. 210, 225-242.
- Hedrick N.G. et al. 2016. Rho GTPase complementation underlies BDNF-dependent homo- and heterosynaptic plasticity. Nature. 538, 104-108.
- Penzes P. et al. 2008. Convergent CaMK and RacGEF signals control dendritic structure and function. Trends Cell Biol. 18, 405-413.
- Herring B.E. and Nicoll R.A. 2016. Kalirin and Trio proteins serve critical roles in excitatory synaptic transmission and LTP. Proc. Natl. Acad. Sci. U.S.A. 113, 2264-2269.
- Bliss T.V. and Collingridge G.L. 1993. A synaptic model of memory: long-term potentiation in the hippocampus. Nature. 361, 31-39.
- Bliss T.V. and Collingridge G.L. 2013. Expression of NMDA-receptor-dependent LTP in the hippocampus: Bridging the divide. Mol. Brain. 6, 5.
- Xie Z. et al. 2007. Kalirin-7 controls activity-dependent structural and functional plasticity of dendritic spines. Neuron. 56, 640-656.
- Penzes P. and Jones K.A. 2008. Dendritic spine dynamics - a key role for kalirin-7. Trends Neurosci. 31, 419-427.
- Ma X.-M. et al. 2008. Kalirin-7 is required for synaptic structure and function. J. Neurosci. 28, 12368-12382.
- Ma X. M. et al. 2011. Kalirin-7, an important component of excitatory synapses, is regulated by estradiol in hippocampal neurons. Hippocampus. 21, 661-677.
- Tolias K.F. et al. 2005. The Rac1-GEF Tiam1 couples the NMDA receptor to the activity-dependent development of dendritic arbors and spines. Neuron. 45, 525-538.
- Zhang H. and Macara I.G. 2006. The polarity protein PAR-3 and TIAM1 cooperate in dendritic spine morphogenesis. Nat. Cell Biol. 8, 227-237.
- Schwechter B. et al. 2013. RasGRF2 Rac-GEF activity couples NMDA receptor calcium flux to enhanced synaptic transmission. Proc. Natl. Acad. Sci. U.S.A. 110, 14462-14467.
- Kim J.-Y. et al. 2011. The RhoG/ELMO1/Dock180 signaling module is required for spine morphogenesis in hippocampal neurons. J. Biol. Chem. 286, 37615-37624.
- Fu W.-Y. et al. 2007. Cdk5 regulates EphA4-mediated dendritic spine retraction through an ephexin1-dependent mechanism. Nat. Neurosci. 10, 67-76.
- Penzes P. et al. 2003. Rapid induction of dendritic spine morphogenesis by trans-synaptic ephrinB-ephB receptor activation of the Rho-GEF kalirin. Neuron. 37, 263-274.
- Xin X. et al. 2008. Regulation of kalirin by cdk5. J. Cell Sci. 121, 2601-2611.
- Tolias K.F. et al. 2007. The Rac1 guanine nucleotide exchange factor Tiam1 mediates EphB receptor-dependent dendritic spine development. Proc. Natl. Acad. Sci. U.S.A. 104, 7265-7270.
- Um K. et al. 2014. Dynamic control of excitatory synapse development by a Rac1 GEF/GAP regulatory complex. Dev. Cell. 29, 701-715.
- Jaudon F. et al. 2015. The RhoGEF DOCK10 is essential for dendritic spine morphogenesis. Mol. Biol. Cell. 26, 2112-2127.
- Kang M.-G. et al. 2009. AMPA receptor and GEF-H1/Lfc complex regulates dendritic spine development through RhoA signaling cascade. Proc. Natl. Acad. Sci. U.S.A. 106, 3549-3554.
- Margolis S.S. et al. 2010. EphB-mediated degradation of the RhoA GEF ephexin5 relieves a developmental brake on excitatory synapse formation. Cell. 143, 442-455.
関連商品
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras-GRF, Human |
CYT | CS-GE03 | 1*100 UG |
¥131,000 |
Tiam1, Human |
CYT | CS-GE04 | 1*100 UG |
¥131,000 |
Vav1, Human |
CYT | CS-GE05 | 1*100 UG |
¥131,000 |
Vav2, Human |
CYT | CS-GE06 | 1*100 UG |
¥131,000 |
RhoGEF Exchange Assay |
CYT | BK100 | 1 KIT [60-300 assays] |
¥227,000 |
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













