記事ID : 10958
神経変性におけるTauの多面性 CYTOSKELETON NEWS 2013年4月号

神経変性におけるTauの多面性
背景
Tau(tubulin-associated unit;チューブリン結合ユニット)は、主として神経細胞で発現する微小管結合タンパク質(MAP)です1。Tauの機能は、微小管の安定化1、微小管依存軸作輸送2、神経突起伸長の調節3に関わっています。Tau機能に混乱が生じると、神経原線維変化(NFTs;neurofibrillary tangles)と呼ばれる異常にリン酸化されたTauの不溶性の凝集物が、神経細胞内に形成されてしまいます。NFTsは、神経変性疾患患者のホールマークであり、まとめてタウオパシー(tauopathy)と呼ばれます1。タウオパシーには、アルツハイマー病(AD)、皮質基底核変性症、ピック病が含まれます1。神経変性の表現型に対するNFTs及びTauの関わりは、まだ議論の余地があり、Tauの凝集のメカニズムは解明されていません。
このニュースレターでは、Tauの翻訳後修飾(PTM;post-translational modifications)と、それらがNFT形成、タウオパシー、神経変性に関連する可能性について焦点を当てます(図1)。
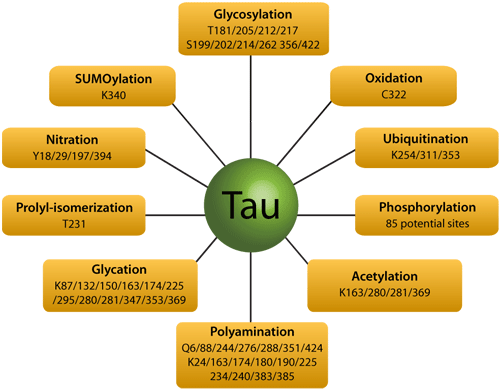
図1 Tauの翻訳後修飾(既知又は推定のアミノ酸基質)5
Tauの翻訳後修飾
リン酸化
Tauのハイパーリン酸化が、Tauを微小管から病理的に分離させ、その後ハイパーリン酸化されたTauの凝集及びNFTsの形成の原因となっているという研究が多数発表されています5及びその引用文献。Tauを修飾するキナーゼ/ホスファターゼが多数見つかっています5。これらのうちのいくつかは、タウオパシー治療のためのターゲットとして提案されています6。異常なTauのリン酸化は、NFTs形成に影響を与えている主要なPTMであると考えられています。しかし、NFT形成の基礎となるメカニズムはまだ完全には理解されていません。
グリコシル化
天然のTauは、セリン及びスレオニン残基にO結合型β-N-アセチルグルコサミン(O-GlcNAc)が付加されることで、広範囲にグリコシル化されています7。O-GlcNAcは、可逆的な修飾で、トランスフェラーゼ酵素(付加)及びヒドラーゼ酵素(除去)により調節されています8,9。培養においても、代謝活性のあるラット脳切片においても、TauのO-GlcNAcレベルは、リン酸化レベルとは反比例しており、2つの修飾が動的平衡の関係にあるという仮説が導き出されます10,11。重要なことに、AD患者の脳のTauのO-GlcNAcレベルは、健常人のものより低く、不溶性のTau凝集物にはO-GlcNAcが完全に消失しています10。このような発見から、O-GlcNAc化の増強が、Tauのハイパーリン酸化を防ぎ、そのためにNFTの形成も軽減できるのではないかという仮説が考えられています12。また、この修飾は直接的にTauの凝集を阻害するという提案もなされています13。このPTMを治療に利用しようとする最新の試みで、グリコシドヒドロラーゼ(O-GlcNAcase)の阻害が注目を集めています12,13。
アセチル化
アセチル化は、可逆的なPTMであり、最近ではTauのリジン残基に対する病理的な修飾として認識されています14、15。AD患者の脳の免疫組織化学的研究により、アセチル化されたTauは、不溶性Tauの凝集に特異的に関わっていることがわかりました。in vitroでの研究では、アセチル化によりTauの微小管の集合促進が妨げられ、Tauの凝集形成が促進することが示されました15。アセチル化はまた、リン酸化されたTauのプロテアソーム分解も減少させます14。Tauのアセチル化をターゲットとすること(おそらくはアセチルトランスフェラーゼの阻害剤を通して)で、NFT形成を減少させることが提案されています6,14-16。
ユビキチン化
非病理的にリン酸化されたTauは、ユビキチン-プロテアソーム分解経路のターゲットとなります17。ユビキチン化は、Tauの凝集物内でも見られますが、プロテアソーム孔のサイズ制限のため、Tau凝集物がプロテアソームの分解・除去の対象となることはにはありそうにありません6。ユビキチンリガーゼのCHIPが、ADの初期段階で、Tauを凝集から保護しているという証拠がいくつか見つかり、Tau分解を増強する治療法の可能性の評価が進んでいます。
プロリル異性化
Tauの231番目のスレオニン残基がリン酸化される(pThr231)と、ペプチジルプロリルイソメラーゼ Pin1によるプロリル異性化の基質となることが明らかになっています19。Pin1は、pThr231-Pro(pThr231の次の配列がプロリン)のTauを認識し、病原性のあるシス体を非病原性のトランス体に変換します20。シス体からトランス体への変化により、Tauの立体構造にも変化が生じ、pThr231-Proの脱リン酸化が容易になり、微小管集合を促進するTauの正常の機能が復活します21。ADマウスモデルにおけるPin1を過剰発現実験で、シス型のpThr231-Proが減少し、Pin1がADのメカニズムに阻害されることが示され、Pin1の阻害を防ぐことで治療できる可能性があるという案が示されています22。
その他のTau PTM及び将来の方向性
SUMO化、糖化、ニトロ化、ポリアミン化、酸化など、Tauには上記以外のPTMもいくつか同定されており、その多くがNFT形成に関わっています5。Tauのリン酸化以外のPTMの研究は、まだ初期の段階です。明らかに、PTMは、正常のTau及び病原性のTauに大きな影響を与えており、治療用及び診断用のアプリケーションとして、将来ターゲットになりうる見込みがあります。
参考文献
1. Avila J., et al. 2004. Role of tau protein in both physiological and pathological conditions. Physiol. Rev. 84, 361-384.
2. Dixit, R., et al. 2008. Differential regulation of dynein and kinesin motor proteins by Tau. Science. 319, 1086-1089.
3. Sadot E., et al. 1995. Short- and long- term mechanisms of tau regulation in PC12 cells. J. Cell Sci. 108, 2857-2864.
4. Kawakami F., et al. 2012. LRRK2 phosphorylates tubulin-associated tau but not the free molecule: LRRK2-mediated regulation of the tau-tubulin association and neurite outgrowth. PLosOne. 7, 1-9.
5. Martin L., et al. 2011. Post-translational modifications of tau protein: Implications for Alzhemer’s disease. Neurochem. Int. 58, 458-471.
6. Lee V., et al. 2011. Developing therapeutic approaches to tau, selected kinases, and related neuronal protein targets. Cold Spring Harbor Perspect. Med. 1:a006437.
7. Arnold C.S., et al. 1996. The microtubule-associated protein tau is extensively modified with O-linked N-acetylglucosamine. J. Biol. Chem. 271, 28741-28744.
8. Kreppel L.K., et al.1997. Dynamic glycosylation of nuclear and cytoplasmic proteins. Cloning and characterization of a unique O-GlcNAc transferase with multiple tetratricopeptide repeats. J. Biol. Chem. 272, 9308-9315.
9. Dong D.L., et al. 1994. Purification and characterization of an O-GlcNac selective N-acetyl-B-D-glucosaminidase from rat spleen cytosol. J. Biol. Chem. 269, 19321-19330.
10. Liu F., et al. 2004. O-GlcNAcylation regulates phosphorylation of tau: a mechanism involved in Alzheimer’s disease. Proc. Natl. Acad. Sci. USA. 101, 10804-10809.
11. Lefebvre T., et al. 2003. Evidence of a balance between phosphorylation and O-GlcNAcylation of tau proteins-a role in nuclear localization. Biochem. Biophys. Acta. 1619, 167-176.
12. Yuzwa S., et al. 2008. A potent mechanism-inspired O-GlcNAcase inhibitor that blocks phosphorylation of tau in vivo. Nat. Chem. Biol. 4, 483-490.
13. Yuzwa S., et al. 2012. Increasing O-GlcNAc slows neurodegeneration and stabilizes tau against aggregation. Nat. Chem. Biol. 8, 393-399.
14. Min SW., et al. 2010. Acetylation of tau inhibits its degradation and contributes to tauopathy. Neuron. 67, 953-966.
15. Cohen T., et al. 2011. The acetylation of tau inhibits its function and promotes pathological tau aggregation. Nat. Commun. 2, 252.
16. Irwin D.J., et al. 2012. Acetylated tau, a novel pathological signature in Alzheimer’s disease and other tauopathies. Brain. 135, 807-818.
17. Zhang J.Y., et al. 2005. Microtubule-associated protein tau is a substrate of ATP/Mg(2+)-dependent proteasome protease system. J. Neural Transm. 112, 547-555.
18. Murayama S., et al. 2005. In vivo evidence of CHIP up-regulation attenuating tau aggregation. J. Neurochem. 94, 1254-1263.
19. Lu P.J., et al. 1999. The prolyl isomerase Pin1 restores the function of Alzheimerassociated phosphorylated tau protein. Nature. 399, 784-788.
20. Lee T.H., et al. 2011. Pin1 in ageing, cancer and Alzheimer disease. Expert Rev. Mol. Med. 13:e21.
21. Zhou X.Z., et al. 2000. Pin1-dependent prolyl isomerization regulates dephosphorylation of Cdc25C and tau proteins. Mol. Cell. 6, 873-883.
22. Nakamura K., et al. 2013. Cis phosphorylated tau as the earliest detectable pathogenic conformation in Alzheimer disease, offering novel diagnostic and therapeutic strategies. Prion. 7, 117-120.
Tau 関連研究ツール
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-A | 1*1 MG |
¥41,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-B | 5*1 MG |
¥189,000 |
Tubulin: MAP-rich (porcine) |
CYT | ML116-A | 1*1 MG |
¥35,000 |
Tubulin: MAP-rich (porcine), Porcine |
CYT | ML116-B | 5*1 MG |
¥169,000 |
Tubulin (HTS format), Porcine |
CYT | HTS03-A | 1*4 MG [8 assays] |
CYT社 HTS03A 2*4 を参照 |
Tubulin (HTS format), Porcine |
CYT | HTS03-B | 1*40 MG [96 assays] |
お問い合わせ |
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥298,000 |
Tubulin Polymerization Assay Kit, Porcine |
CYT | BK004P | 1 KIT [24 assays] |
¥209,000 |
Tubulin Polymerization Assay |
CYT | BK011P | 1 KIT [96 assays] |
¥302,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













