記事ID : 15639
アクチン細胞骨格のライブセルイメージング CYTOSKELETON NEWS 2015年7月号

アクチン細胞骨格のライブセルイメージング
近年の有機合成化学の進歩により、アクチン細胞骨格を効率的に標識して、その動的な特徴の追跡に使用できる、細胞膜透過性の低分子化合物の製造が可能になりつつあります1-3。従来は、細胞や組織においてF-アクチンを可視化するには、あらかじめ標識したアクチンタンパク質4,5 または 蛍光標識したファロイジン様分子6,7 をマイクロインジェクションするか(図1)、GFP-アクチン8,9 または GFP-アクチン結合タンパク質(ペプチド)10-12 のいずれかをコードする遺伝子コンストラクトを用いる方法が一般的でした。
蛍光色素(例: ローダミン)によるアクチンの標識や、マイクロインジェクション装置の設定は、非常に時間のかかる作業です。しかし、研究室でマイクロインジェクションシステムを利用可能で、市販の標識アクチンを使用する場合は、効率的に行うことができます。マイクロインジェクション法は、比較的簡単にインジェクションできるアフリカツメガエル卵母細胞(直径 1mm)などの大きな細胞や、トランスフェクション試薬に感受性が高い細胞、Spirochrome™ 試薬が取り込まれにくい細胞などに、特に適しています1-3(図2)。マイクロインジェクション法の主な利点として、次の3点が挙げられます。
- a) 標識アクチンがアクチン細胞骨格に完全に統合される(分子量の大きいGFPの標識による立体障害や、ファロイジンのようにF-アクチンを安定化させる特性による影響がない)。
- b) インジェクション後、迅速に(通常は数分以内に)観察を開始することができる。
- c) 光退色後蛍光回復(FRAP: fluorescence recovery after photobleaching)を用いて、動的なターンオーバーを測定できる13。
また、市販の標識済み筋細胞/非筋細胞アクチン(品番: AR05 / APHR)を利用すると、目的の細胞の種類に合ったアクチンアイソフォームの作製が可能となり、標識物の取り込みが向上することから、より鮮明に可視化することができます。
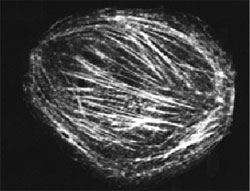
図1 COS 細胞にマイクロインジェクションしたローダミン標識非筋細胞アクチン(品番: APHR)
(ノースウェスタン大学 R. Goldman 博士ら)
近年は、DNA/RNAトランスフェクションにより、GFP-アクチンの遺伝子コンストラクトを導入する方法が広く用いられてきました8,9。オリゴヌクレオチドをトランスフェクション混合物に加え、24-48 時間インキュベートするだけで可視化することができます。注意が必要となるのは次の3点です。
- a) シグナルを検出するまでに時間がかかる
- b) トランスフェクション効率にばらつきがあり、細胞集団が不均一になる
- c) 比較的分子量の大きいGFPの立体障害により、GFPのバックグラウンドが上昇したり、ターンオーバーが非常に活発な細胞周辺部に近い領域で発現が低下したりする場合がある
また、GFP標識したアクチン結合ペプチドも広く使用されており、上述のGFP-アクチンと同様の利点があります。ABP140(Saccharomyces cerervisiae)、ABP120(Dictyostelium discoideum)、タリン(ヒト)などのアクチン結合タンパク質に由来するペプチドを用いた結果が、これまでに報告されています10-12。これらのコンストラクトは、F-アクチンへの結合親和性が高く、バックグラウンドが低いことが特長で、製品として市販されているもの(例: ABP140、ABP120)の他、様々な大学の研究室から入手することができます。
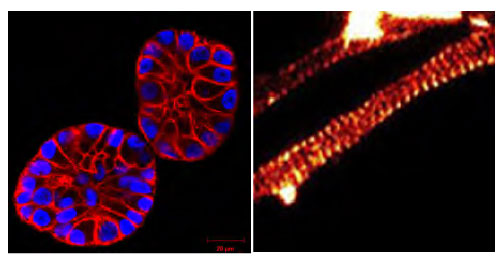
図2
(左図)SiR-actin で染色した3D基質内の MCF10A 細胞(画像のご提供: Christian Conrad and Katharina Jechow, Heidelberg)。
(右図)SiR-actin で染色した軸索。アクチンが 180 nm 間隔のバンドパターンを示す (画像のご提供: Elisa D'Este, MPI Biophysical Chemistry, Göttingen; 参考文献 3)。
GFP標識したアクチン結合ペプチドにも、GFP-アクチンと同様の注意点がありますが、細胞の種類によって程度が異なります。細胞膜透過性の蛍光標識ペプチドを用いることが可能になれば、より簡単に標識できますが、まだ成功例がありません。近年開発された Spirochrome™ 試薬(例: SiR-アクチン)(図2)は、上述した方法で起こる問題点の多くを解決できる試薬です。この低分子シリコンローダミン(SiR)蛍光分子は、2014年に Johnsson、Hell、Arndt 博士の研究室で Lukinavicius ら3 によって開発されました。細胞膜透過性を有し、F-アクチンに結合すると蛍光強度が最大 100 倍に増加することから、バイオセンサーとして使用できます。また、このプローブは近赤外(遠赤)に励起/蛍光波長を持つことから、サンプルの自家蛍光が低減され、励起光による光毒性が抑えられます。これは非常に画期的な特性で、非結合状態での細胞質におけるバックグラウンドが大幅に低減されるため、F-アクチンへの結合親和性がそれほど高い必要がなく、標識していない元の分子(例: ファロイジンやジャスプラキノリド)と比較して、結合してもダイナミクスの阻害が起こりません。開発の際に、数種類の分子について試験を行ったところ、ジャスプラキノリド誘導体が、細胞透過性とF-アクチンの染色において最も良好な結果を示しました3。このシステムを用いて、様々な種類の細胞を標識した実績がありますが(「Spirochrome プローブ」商品記事参照)、標識が困難な細胞では、細胞膜の透過性を向上させる試薬6(例: サポニン)や、排出ポンプ/Ca2+ チャネル阻害剤(例: ベラパミル)が必要となる場合があります。Spirochrome™ 試薬を用いた標識は簡単で、培養細胞に蛍光試薬を添加して、短時間(通常は 1-4 時間)インキュベートするだけです。
まとめ
生細胞内で F-アクチンを可視化する技術は、アクチンを調製・標識してマイクロインジェクションを行うという専門性が高く労力を要する「一部の人だけができる」方法から、より簡単なDNAトランスフェクションを経て、ついに、細胞培養培地に試薬を添加するだけという、最も簡単で広く利用可能な方法に進化してきました。この技術をすべての細胞で利用できるようにすることと、蛍光色素の種類を増やすことが、今後の課題となります。
Spirochrome™ は、Spirochrome AG(スイス)の登録商標です。
参考文献
- Lukinavicius G. et al. 2013. A near-infrared fluorophore for live cell super-resolution microscopy of cellular proteins.Nature Chem. 5, 132-139.
- Lukinavicius G. et al. 2014. Fluorogenic probes for live-cell imaging of the cytoskeleton. Nat. Methods. 11, 731-3.
- D’Este E. et al. 2015. STED nanoscopy reveals the ubiquity of subcortical cytoskeleton periodicity in living neurons.Cell Rep. 10, 1246-1251.
- Wang Y.L. et al. 1982. Mobility of cytoplasmic and membrane-associated actin in living cells. Proc. Natl. Acad. Sci. U.S.A. 79, 4660–4664.
- Wang Y.L. and Taylor DL. 1979. Distribution of fluorescently labeled actin in living sea urchin eggs during early development. J. Cell Biol. 81, 672-9.
- Barak L. et al. 1980. Fluorescence staining of the actin cytoskeleton in living cells with 7-nitrobenz-2-oxa-1,3-diazole-phallacidin. 1980. Proc. Natl. Acad. Sci. U.S.A. 77, 980-984.
- Huang Z.J. et al. 1992. Phallotoxin and actin binding assay by fluorescence enhancement. Anal. Biochem. 200, 199-204.
- Doyle T. and Botstein D. 1996. Movement of yeast cortical actin cytoskeleton visualized in vivo. Proc. Natl. Acad. Sci. U.S.A. 93, 3886-91.
- Westphal M. 1997. Microfilament dynamics during cell movement and chemotaxis monitored using a GFP-actin fusion protein. Curr. Biol. 7, 176-83.
- Riedl J. et al. 2008. Lifeact: a versatile marker to visualize F-actin. Nat. Methods. 5, 605.
- Pang K.M. et al. 1998. Use of a fusion protein between GFP and an actin-binding domain to visualize transient filamentous-actin structures. Curr. Biol. 8, 405-408.
- Kost B. et al. 1998. A GFP-mouse talin fusion protein labels plant actin filaments in vivo and visualizes the actin cytoskeleton in growing pollen tubes. Plant J. 16, 393-401.
- Wang Y.L. et al. 1985. Exchange of actin subunits at the leading edge of living fibroblasts: Possible role of treadmilling. J. Cell Biol. 101, 597-602.
ライブセルイメージングプローブ
- Spirochrome プローブ(SiR-Actin/SiR-Tubulin)
- STED顕微鏡での細胞骨格(アクチン・チューブリン)観察に最適
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥182,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥182,000 |
PTMtrue™ 抗体
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
CYT社 AAC01L 2*100 を参照 |
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥38,000 |
Anti Phosphotyrosine, (Mouse) , 27B10.4 |
CYT | APY03 | 2*100 UL |
CYT社 APY03 3*100 を参照 |
Anti Phosphotyrosine (Trial Size), (Mouse) , 27B10.4 |
CYT | APY03-S | 1*25 UL |
¥18,000 |
Anti Phosphotyrosine, (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP | 1*100 UL |
CYT社 APY03HRPL 1*100 を参照 |
Anti Phosphotyrosine (Trial Size), (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP-S | 1*25 UL |
¥50,000 |
Anti SUMO-2/3, (Mouse) , 12F3 |
CYT | ASM23 | 200 UL [2 x 100 μl] |
CYT社 ASM23L 2*100 を参照 |
Anti SUMO 2/3 (Trial Size), (Mouse) , 12F3 |
CYT | ASM23-S | 25 UL [1 x 25 μl] |
¥38,000 |
Anti SUMO-2/3, (Mouse) , 11G2 |
CYT | ASM24 | 2*200 UL |
CYT社 ASM24L 2*200 を参照 |
Anti SUMO-2/3 (Trial Size), (Mouse) , 11G2 |
CYT | ASM24-S | 1*150 UL |
¥49,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
CYT社 AUB01L 2*100 を参照 |
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥38,000 |
標識タンパク質
- アクチンタンパク質・アクチン結合タンパク質
- 高純度チューブリン試薬
- ローダミン標識 Tubulin もラインアップ
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-A | 4*10 UG |
¥108,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-C | 20*10 UG |
¥339,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-B | 10*20 UG |
¥104,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-C | 20*20 UG |
¥200,000 |
Tubulin, Porcine, 7-amino-4-methylcoumarin-3-acetic acid |
CYT | TL440M-A | 5*20 UG |
¥126,000 |
Tubulin, Porcine, 7-amino-4-methylcoumarin-3-acetic acid |
CYT | TL440M-B | 20*20 UG |
¥303,000 |
Tubulin, Porcine, Tetramethylrhodamine |
CYT | TL590M-A | 5*20 UG |
¥126,000 |
Tubulin, Porcine, Tetramethylrhodamine |
CYT | TL590M-B | 20*20 UG |
¥303,000 |
Tubulin, Porcine, HiLyte FluorTM 647 |
CYT | TL670M-A | 5*20 UG |
¥126,000 |
Tubulin, Porcine, HiLyte FluorTM 647 |
CYT | TL670M-B | 20*20 UG |
¥303,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













