
記事ID : 34387
SUMO レスリング: バランスが全て CYTOSKELETON NEWS 2018年7月号

SUMO レスリング: バランスが全て
哺乳動物細胞には、小分子のユビキチン様修飾因子(SUMO)ファミリーとして4種のアイソフォーム(SUMO1、SUMO2、SUMO3、およびSUMO4)が存在します。SUMO2とSUMO3はほぼ同一であり、わずか3つのアミノ酸残基が異なるだけです。SUMO1はSUMO2/3と48%の同一性をもちます1。SUMO4はSUMO2/3とおよそ85%同一ですが、SUMO4が基質と結合するかどうかは不明です2。ユビキチン化と同様に、SUMO化において標的基質にSUMOを共有結合させるためには3種の酵素システム(E1、E2、およびE3)が必要です。SUMOはまず、SUMO E1活性化ヘテロ二量体酵素SAE1/SAE2によりATP依存性反応においてアデニル化され活性化されます。活性化されたSUMOは、その後SUMO E2結合酵素UBC9に転移され、最後にSUMO E3リガーゼ(例:PIASファミリーメンバー、Ran結合タンパク質2)により標的タンパク質に結合します。共有結合したSUMOは、脱SUMO化と呼ばれる過程によりセントリン特異的プロテアーゼ(SENPs)によって除去されることがあります3 (図. 1)。SUMO化は、標的タンパク質の活性度、細胞内局在、安定性、および機能を制御する重要な翻訳後修飾(PTM)であるため、ほぼ全ての主要な細胞経路を調節するといえます4。したがって、多くの疾患がSUMO化の調節不全に関連していても驚くことではないでしょう。本ニュースレターでは、がんにおけるSUMO化/脱SUMO化の役割を議論します。
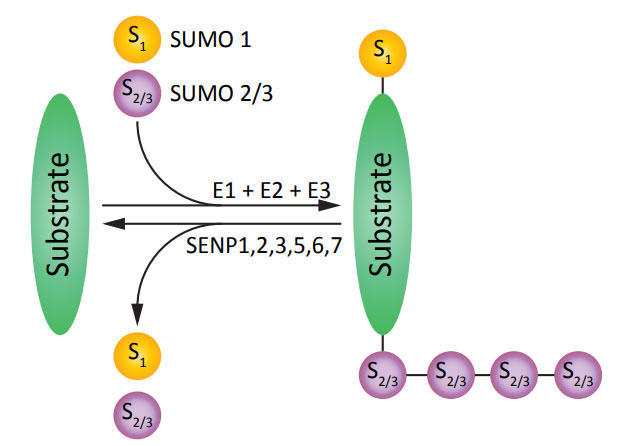
図.1 SUMO化と脱SUMO化のプロセスの概要
がん発生におけるSUMO化
がんは、細胞が異常に生育するときに発生します。細胞周期進行に関与する多くの制御タンパク質はPTMsにより堅固に制御されており、SUMO化は細胞周期進行や、がん制御における主要なプレーヤーのひとつとして認識されています5。SUMO結合経路の構成要素を過剰発現すると、腫瘍増殖が後押しされます。例えば、腫瘍性タンパク質であるMycはSUMO活性化酵素E1(SAE1)の転写を活性化します6。SAE1とそのパートナーであるSAE2はMyc駆動性の腫瘍発生を補助する上で重要な役割を担います。SAE2の欠乏によりSUMO1またはSUMO2/3修飾タンパク質レベルが大きく低減し、これによりMyc依存性乳がん増殖やクローン形成能が減少します7。また、SUMO E2結合酵素であるUBC9はがん発生の初期段階で重要であり、肺がん、原発性結腸がん、および、前立腺がんにおいて高発現するとの報告もあります8。興味深いことに、UBC9レベルは、対応する正常組織や初代腫瘍に比べて、転移性乳がん、肺がん、および前立腺がんにおいて下方制御されています。ウイルス(HPV)介在型の頭部と頸部の腫瘍発生では、UBC9レベルは自己貪色過程を介して上方制御されています8。アストロサイトの脳腫瘍では、UBC9、SUMO1-、およびSUMO2/3-抱合型タンパク質が腫瘍増殖を促進します。神経膠芽腫細胞においてSUMO1-3結合を遮断すると、DNA2本鎖損傷やG2/M細胞周期停止によりDNA合成、細胞増殖、およびクローン形成能が損なわれます10。さらに、SUMO E3リガーゼであるPIAS1は腫瘍発生に関与します11。PIAS1は前立腺がんにおいて増幅され、p21を抑制することで細胞増殖を促進します12。PIAS1はMyc駆動型B細胞リンパ腫において高発現します。また、SUMO化依存性でMycを安定化します。PIAS1は、MycのS62におけるリン酸化を促進し、これによりMycとその転写活性の安定化と上方制御が誘導されます13。
がん発達における脱SUMO化
SENPによる脱SUMO化はSUMOホメオスタシスを細胞内で維持しています。しかしながら、脱SUMO化における異常な活性も腫瘍形成を促進します14。 SENP1の過剰発現は、前立腺がんの発症に関連しています。前立腺がん標本からの分析は、SENP1発現が前立腺がんの攻撃性および再発と直接相関することも明らかにしています15。 SENP1は、アンドロゲンまたはインターロイキン-6で処置した前立腺がん細胞において上方制御されます。 SENP1の上方制御は、アンドロゲン依存性転写およびc-Jun依存性転写を増強します。両方とも前立腺がんの発達にとって重要です16。興味深いことに、siRNAによるSENP2の遮断は、β-カテニンの安定性の増加を介して肝細胞がんの増殖を促進します17。おそらくp53の転写活性およびp2118の発現を阻害することにより、SENP3の上方制御は上皮性卵巣がんの進行を促進します。SENP3の過剰発現は口腔扁平上皮癌の分化と関連しています19。SENP5の上方制御は、骨肉腫細胞の増殖を促進し20、肝細胞がんの腫瘍形成を促進しています21。 SENP6は、肝細胞がん組織において過剰発現されます。shRNAによるSENP6のサイレンシングは、肝細胞がん細胞株における増殖阻害および放射線増感を誘導します22。乳房上皮において、長いSENP7スプライス変異体の過剰発現は、乳房上皮間葉移行を促進します23。
がんにおけるSUMO化経路の標的
SUMO化経路は、がんの治療標的候補となりました。小分子STEがSUMO E1活性化酵素の活性を阻害し、これによりSUMO化が損なわれ、肺がん細胞増殖が阻害されます。Myc駆動型がんは、その生存をSUMO E1活性に高度に依存しているため、この点は特に重要となります24。また、ギンコール酸がSUMO E1に直接結合し、SUMO化を阻害するとの報告もあります。ギンコール酸処置によりNOTCH1駆動型の乳房上皮細胞の増殖を阻害することから、NOTCH1駆動型乳がんに対するギンコール酸治療効果の可能性が示唆されました25。急性骨髄性白血病治療に使用されるいくつかの化学療法薬は活性酸素種の形成を誘導するため、SUMO E1活性化酵素とSUMO E2結合酵素間の相互作用が阻害され、その後、腫瘍増殖の低減が生じます26。亜ヒ酸は伝統中国医学で使用される古来の薬物ですが、これがSUMO化と、引き続いて生ずるPMLや急性前骨髄球性白血球の発生を駆動する融合型腫瘍性タンパク質であるPML-RARaの分解を促進することが示されています27。
まとめ
アセチル化、リン酸化、ユビキチン化、およびSUMO化といったPTMsは、タンパク質構造、細胞内局在、および全ての主要な細胞経路における活性を制御します。がん、心不全、神経変性、および脳虚血/脳卒中をはじめとする様々なヒト疾患がSUMO化の調節不全と関連していることが多くの研究で示されています3。しかしながら、どのようにSUMO化/脱SUMO化と病態に寄与する他のPTMsとが相互作用(例えばクロストーク)するのかに関しては、未だに研究されていない領域があります。Cytoskeleton社では、研究者の方々がPTMs修飾タンパク質の内在性レベルを同定したり評価したりする際に役立ついくつかのSignal-SeekerTMP™ Detection Kitsをご提供しています。
参考文献
- Guo C. and Henley J. 2014. Wrestling with stress: Roles of protein SUMOylation and deSUMOylation in cell stress response. IUBMB Life. 66, 71-77.
- Owerbach D. et al. 2005. A proline-90 residue unique to SUMO-4 prevents maturation and sumoylation. Biochem. Biophys. Res. Comm. 337, 517-520.
- Yang W. and Paschen W. 2015. SUMO proteomics to decipher the SUMO-modified proteome regulated by various diseases. Proteomics. 15, 1181-1191.
- Kira B. et al. 2012. SUMOylation in carcinogenesis. Cancer Lett. 316, 113-125.
- Eifler K. and Vertegaal A. 2015. SUMOylation-mediated regulation of cell cycle progression and cancer. Trends Biochem. Sci. 40, 779-793.
- Amente A. et al. 2012. SUMO-activating SAE1 transcription is positively regulated by Myc. Am. J. Cancer Res. 2, 330-334.
- Kessier J. et al. 2012. A SUMOylation-dependent transcriptional subprogram is required for Myc-driven tumorigenesis. Science. 335, 348-353.
- Mattoscio D. et al. 2017. Autography regulates UBC9 levels during viral-mediated tumorigenesis. PLoS Pathog. 13, e1006262.
- Moschos S. et al. 2010. Expression analysis of Ubc9, the single small ubiquitin-like modifier (SUMO) E2 conjugating enzyme, in normal and malignant tissues. Hum. Pathol. 41, 1286-1298.
- Yang W. 2013. Small ubiquitin-like modifier 1-3 conjugation is activated in human astrocytic brain tumors and is required for glioblastoma cell survival. Cancer Sci. 104, 70-77.
- Rabellino A. et al. 2017. The role of PIAS SUMO E3- ligases in cancer. Cancer Res. 77, 1-6.
- Hoefer J. et al. 2012. PIAS1 is increased in human prostate cancer and enhances profileration through inhibition of p21. Am. J. Pathol. 180, 2097-2107.
- Rabellino A. et al. 2016. PIAS1 promotes lymphomagenesis through Myc upregulation. Cell Rep. 15, 2266-2278.
- Kim J. and Baek S. 2009. Emerging roles of deSUMOylating enzymes. Biochimica Biophysica Acta. 1792, 155-162.
- Wang Q. et al. 2013. SUMO-specific protease 1 promotes prostate cancer progression. Oncogene. 32, 2493-2498.
- Cheng J. et al. 2006. Role of deSUMOylation in the development of prostate cancer. Neoplasia. 8, 667-676.
- Shen H. et al. 2012. SENP2 regulates hepatocellular carcinoma cell growth by modulating the stability of b-catenin. Asian Pac. J. Cancer Prev. 13, 3583-3587.
- Cheng J. 2017. Upregulation of SENP3/SMT3Ip1 promotes epithelial ovarian cancer progression and forecasts poor prognosis. Tumor Biol. 39, 1010428317694543.
- Ding X. et al. 2008. Overexpression of SENP3in oral aquamous cell carcinoma and its association with differentiation. Oncol. Rep. 20, 1041-1045.
- Wang K. et al. 2014. Inhibition of SENP5 suppresses cell growth and promotes apoptosis in osteosarcoma cells. Exp. Ther. Med. 7, 1691-1695.
- Jin Z. et al. 2016. The SMO-specific protease SENP5 controls DNA damage response and promotes tumorigenesis in hepatocellular carcinoma. Eur. Rev. Med. Pharmacol. Sci. 20, 3566-3573.
- Qian J. et al. 2013. Inhibition of SEMP6-induced radiosensitization of human hepatocellular carcinoma cells by clocking radiation-induced NF-kappaB activation. Cancer Biother. Radiopharm. 28, 196-200.
- Bawa T. et al. 2012. Differential expression of SUMO-specific protease 7 variants regulates epithelial-mesenchymal transition. Proc. Natl. Acad. Sci. USA. 109, 17466-17471.
- Etuale. M. et al. 2013. A Novel inhibitor of SUMOylation pathway: Understanding the mechanism of action. UCR. Undergraduate Res. J. 7, 60-65.
- Licciardello M. 2014. NITCH1 activation in breast cancer confers sensitivity to inhibition of SUMOylation . Oncogene. DOI:10.1038/onc.2014.319.
- Bossis G. et al. 2014. The ROS/SUMO axis contributes to the response of acute myeloid leukemia cells to chemotherapeutic drugs. Cell Rep. 7, 1815-1823.
- Lalleman-Breitenbach V. et al. 2008. Arsenic degrades PML-PML-RARalpha through a SUMO-triggered RNF4/ubiquitin-mediated pathway. Nat. Cell Biol. 10, 547-555.
Signal Seeker™ Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
CYT社 BK163L 1 を参照 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
CYT社 BK160L 1 を参照 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
CYT社 BK161L 1 を参照 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
CYT社 BK162L 1 を参照 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥128,000 |
PTM Antibodies, Beads, Etc
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Mouse)  |
CYT | AAC02 | 2*100 UL |
CYT社 AAC02L 2*100 を参照 |
Anti Acetyl Lysine (Mouse)  |
CYT | AAC03 | 2*100 UL |
CYT社 AAC03L 2*100 を参照 |
Anti Acetyl Lysine (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP | 1*100 UL |
¥150,000 |
Anti Acetyl Lysine Affinity Beads (Mouse)  |
CYT | AAC04-BEADS | 4*500 UL |
CYT社 AAC04BEADSA 4*500 を参照 |
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti Phosphotyrosine, (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP | 1*100 UL |
CYT社 APY03HRPL 1*100 を参照 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
CYT社 ASM24BEADSA 2*400 を参照 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
CYT社 AUB01L 2*100 を参照 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
CYT社 CIG01BEADS10 10 を参照 |
Control for Acetyl- immunoprecipitation IgG beads |
CYT | CIG02-BEADS | 10 ASSAY |
CYT社 CIG02BEADS10 10 を参照 |
Control for Ubiquitin Affinity Beads |
CYT | CUB02-BEADS | 10 ASSAY |
CYT社 CUB02BBEADS 10 を参照 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













