記事ID : 36603
Rho GTPaseによる細胞遊走制御 CYTOSKELETON NEWS 2020年1月号

Rho GTPaseによる細胞遊走制御
方向性をもった細胞遊走は、細胞のアクチン細胞骨格と細胞外基質(ECM)を接続し、機械的な力を伝達するインテグリン含有フォーカルアドヒージョン(Focal adhesion:FA)に依存しています。フォーカルアドヒージョンの形成とその後の細胞遊走は、細胞外の誘導合図に応じて、細胞の後縁でのアクチンベースの収縮繊維、細胞の最前縁での突起の動的な再編成がそれぞれ必要です。細胞遊走は、健康な細胞(および生物)の発生、増殖、成熟、および疾患、損傷、および/または免疫系の攻撃に対する生理学的応答に不可欠です。様々な病態生理学的状態(例えば、癌、線維症、感染症、慢性炎症)は、細胞遊走の根底にある動的な生理学的プロセスを乱したり、損なったりします1-5)。
RhoファミリーGTPアーゼ(例えば、RhoA、Rac1、Cdc42、およびRhoJ)は分子スイッチとして作用し、GTP結合「オン」状態とGDP結合「オフ」状態との間を循環します。活性化(訳注:GTP結合「オン」状態)はグアニンヌクレオチド交換因子(guanine nucleotide exchange factors:GEFs)を介して行われ、内因性GTPase活性は、GTP-活性化タンパク質(GTP-activating proteins:GAPs)により増幅および活性化されます。RhoファミリーGTPaseは、細胞突起(つまり、糸状仮足と葉状仮足;それぞれRacとCdc42によって調節される)の形成、伸長、退縮、分解に必要なアクチンフィラメントの動的な集合と分解を細胞の前縁で、収縮性アクトミオシン線維(RhoAによって調節される)の動的な集合と分解を細胞の後端で調節している1-8)(図1)。興味深いことに、近年の研究ではRhoAは細胞の前縁においても活性化されていることが明確に示されています1, 9-12)。特に興味深いのは、これらのGTPasesがアクチン細胞骨格の動的な再編成を介して、どのようにして細胞遊走や遊走力の産生を制御しているかということです1-3, 13, 14)(図1)。本ニュースレターでは、細胞遊走時の細胞-ECM接着と細胞方向性の樹立および制御におけるRho-ファミリーGTPasesの役割について討論します。
フォーカルアドヒージョン
RhoAシグナル伝達を除去するとF-アクチンストレス線維形成が防止されます。この知見より、細胞とECM間の相互作用(フォーカルアドヒージョンのような)の制御におけるRho-ファミリーGTPasesの重要性が示されました1, 7)。活性化RhoJ(RhoファミリーメンバーでありCdc42に関連)GTPaseは、インテグリン含有フォーカルアドヒージョンに局在化し、その解体を制御します。GTP-結合RhoJは、Rac GEF β-PixとArf GAPs GIT1/2から構成されるマルチタンパク質複合体をフォーカルアドヒージョンへと輸送し、RhoA活性化を妨げつつRac1とCdc42活性化を促進します15, 16)。この輸送の結果、RhoA活性とアクトミオシン収縮の低下を伴うフォーカルアドヒージョン解体と運動性増加が生じます7, 15-17)。フォーカルアドヒージョン(特にインテグリン含有フォーカルアドヒージョン)とRho-ファミリーGTPases間の間接的な情報交換はECMを介しています。例えば、Rac1ではなくCdc42活性化は、新生ラメリポディア形成をサポートするECMタンパク質フィブロネクチンの沈着を引き起こします。フィブロネクチンはインテグリンに結合し、Rac1依存性の方向性遊走のECMとして機能します18)。
細胞の方向性
Rhoファミリーが介在するアクチン細胞骨格再編成は、細胞外の誘導合図(例えば、ケモカイン、基質放出分子、増殖因子、など)に対する細胞の方向性応答に必要です。その応答とは、環境合図に向かう、またはそれから離れる遊走であり、この方向性応答にはアクチン細胞骨格の動的な再編成が必要です。ここで核心となる問題は、細胞外情報をアクチン細胞骨格へと中継するシグナル伝達分子(分子群)の正体です1-4)。定説はPI3キナーゼですが、この仮説は疑問視されています19-24)。新規候補ファミリーとして、Rho-ファミリーGTPasesが挙げられています1)。例えば、集合的に遊走するショウジョウバエのボーダー細胞(border cells)の前縁におけるRac1活性は、安定した、組織化された前方移動に必要です。また、E-カドヘリンが誘導合図を機械的に伝達した際に、Rac1介在性の前方突起は、E-カドヘリンが介在する正のフィードバックループの一環として増大します25)。Racは、線維芽細胞の遊走も制御します26)。In vitroでは、遊走しているマウスC2C12筋芽細胞におけるE-カドヘリン介在性機械的シグナル伝達の際、接着分子が遊走細胞の前縁においてCdc42を活性化します。Cdc42は、E-カドヘリンによる方向性細胞遊走や遊走力産生に必須です27)。さらに、Cdc42は細胞が環境合図に応答する前に活性化され、好中球遊走を指示し、Cdc42はRac活性化と協調して、おそらく広範な細胞のアクチン骨格再編成を介して細胞運動に動力を与えます。Cdc42活性化はRhoA活性をも阻害することから、方向性遊走においては2種のGTPasesが対立して作用することが示唆されます。
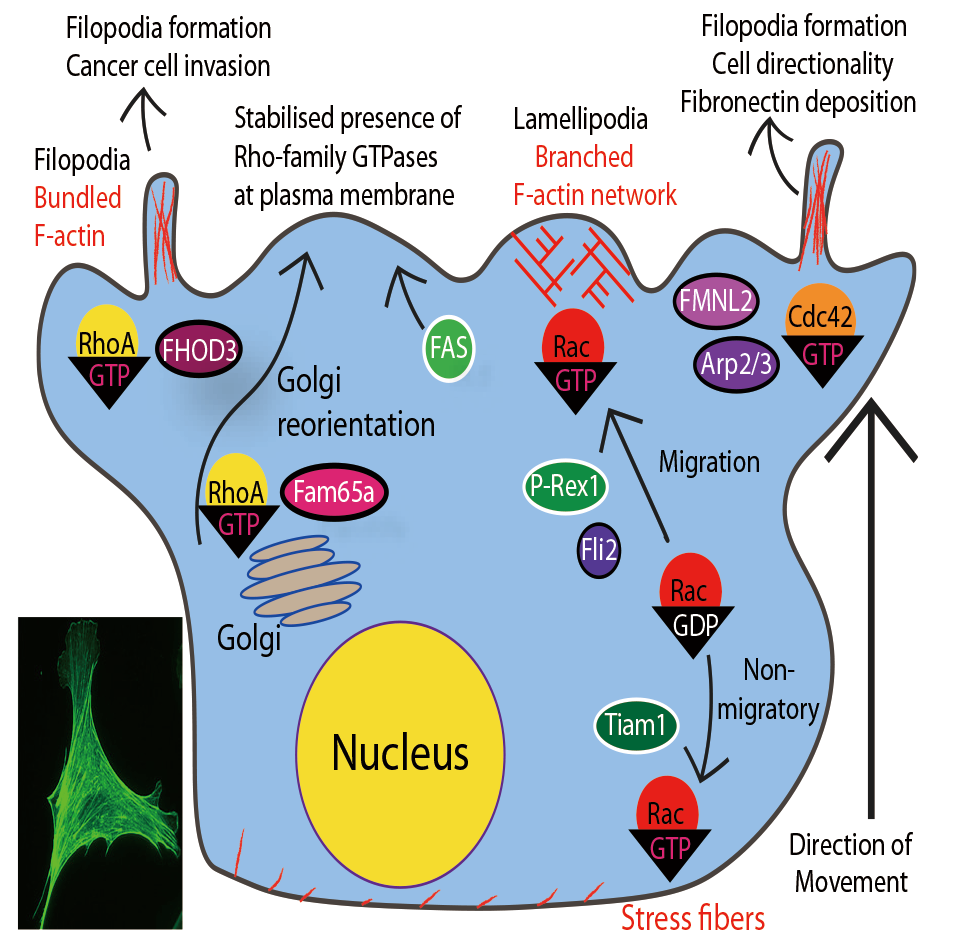
図1. 細胞-ECM接着や細胞遊走におけるRho-ファミリーGTPasesの役割
細胞前縁においてRho-ファミリー介在性でアクチン重合化駆動性の葉状仮足(Rac)と糸状仮足(Cdc42)形成が生じ、細胞は葉状仮足を基盤として遊走できる。また、Rac介在性アクトミオシン収縮性により後縁における退縮が促進される。Cdc42は、マトリックスメタロプロテアーゼ(MMP)を介したマトリックス分解を介して、アクチンに富む浸潤突起のECMへの突出を仲介します。挿入図(左下):細胞における葉状仮足と尾部退縮。F-アクチンはActi- Stain™ 488(Cat. #PHDG1)を用いて染色
まとめ
細胞-ECM接着や細胞遊走におけるRho-ファミリーGTPasesの役割は非常に理解が進んだものの、未だ数々の疑問が残されています。2D培養から得られた細胞培養データのほとんどは、今では3D細胞培養モデルによる確認が必要となっています。これらのシグナル伝達カスケードが基本的な生理学的経路を制御しているだけでなく、ヒトの病理学的状態で破壊されていることから、細胞-ECM(および、細胞間)相互作用におけるRho-ファミリーGTPasesの役割を研究する際には、この点が特に重要となります。ほかにも重要なこととして、Rho-ファミリーGTPasesは、細胞の種類や状況(疾患モデルにおいてはがんの種類さえにも)に応じて細胞-ECM接着や遊走行動に対して異なる役割(または、少なくとも寄与度の異なるもの)を持つ場合があるということです。最も重要なのは、すべてのRhoファミリーGTPase結合パートナーを同定すること、内因性および外因性シグナルを細胞および細胞応答に統合するシステムレベルでのシグナルカスケードの研究に重点を置くことです。研究者がRho-ファミリーGTPasesによる細胞接着や遊走の制御を解明するのを支援するため、Cytoskeleton, Inc. では、様々なGTPase活性化アッセイ、抗体、翻訳後修飾研究に向けたSignal-Seekerキット、F-アクチン用生細胞画像処理プローブ、および細胞骨格(GTPases、アクチン、およびチューブリン)シグナル伝達試薬と機能アッセイをご提供しています。
参考文献
- Warner H. et al. 2019. Control of adhesion and protrusion in cell migration by Rho GTPases. Curr. Opin. Cell Biol. 56, 64-70.
- Lawson C.D. and Ridley A.J. 2018. Rho GTPase signaling complexes in cell migration and invasion. J. Cell Biol. 217, 447-457.
- Ridley A.J. 2011. Life at the leading edge. Cell. 145, 1012-1022.
- Sit S.-T. and Manser E. 2011. Rho GTPases and their role in organizing the actin cytoskeleton. J. Cell Sci. 124, 679-683.
- Hodges R.G. and Ridley A.J. 2016. Regulating Rho GTPases and their regulators. Nat. Rev. Mol. Cell Biol. 17, 496-510.
- Ridley A.J. et al. 1992. The small GTP-binding protein rac regulates growth factor-induced membrane ruffling. Cell. 70, 401-410.
- Ridley A.J. and Hall A. 1992. The GTP-binding protein rho regulates the assembly of focal adhesions and actin stress fibers in response to growth factors. Cell. 70, 389-399.
- Nobes C.D. and Hall A. 1995. Rho, Rac, and Cdc42 GTPases regulate the assembly of multimolecular focal complexes associated with actin stress fibers, lamellipodia, and filopodia. Cell. 81, 53-62.
- Goulimari P. et al. 2005. Galpha12/13 is essential for directed cell migration and localized Rho-Dia1 function. J. Biol. Chem. 280, 42242-42251.
- Kurokawa K. and Matsuda M. 2005. Localized RhoA activation as a requirement for the induction of membrane ruffling. Mol. Biol. Cell. 16, 4294-4303.
- Pertz O. et al. 2006. Spatiotemporal dynamics of RhoA activity in migrating cells. Nature. 440, 1069-1072.
- Machacek M. et al. 2009. Coordination of Rho GTPase activities during cell protrusion.Nature 461, 99-103.
- Aspenstrom P. et al. 1996. Two GTPases, Cdc42 and Rac, bind directly to a protein implicated in the immunodeficiency disorder Wiskott-Aldrich syndrome. Curr. Biol. 6, 70-75.
- Machesky L.M. et al. 1999. Scar, a WASp-related protein, activates nucleation of actin filaments by the Arp2/3 complex. Proc. Natl. Acad. Sci. USA. 96, 3739-3744.
- Wilson E. et al. 2014. RhoJ interacts with the GIT-PIX complex and regulates focal adhesion disassembly. J. Cell Sci. 127, 3039-3051.
- Vicente-Manzanares M. and Horwitz A.R. 2011. Adhesion dynamics at a glance. J. Cell Sci. 124, 3923-3927.
- Chrzanowska-Wodnicka M. and Burridge K. 1996. Rho-stimulated contractility drives the formation of stress fibers and focal adhesions. J. Cell Biol. 133, 1403-1415.
- Zimmerman S.P. et al. 2017. Cells lay their own tracks - optogenetic Cdc42 activation stimulates fibronectin deposition supporting directed migration. J. Cell Sci. 130, 2971-2983.
- Berzat A. and Hall A. 2010. Cellular responses to extracellular guidance cues. EMBO J. 29, 2734-2745.
- Bear J.E. and Haugh J.M. 2014. Directed migration of mesenchymal cells: where signaling and the cytoskeleton meet. Curr. Opin. Cell Biol. 30, 74-82.
- Rickert P. et al. 2000. Leukocytes navigate by compass: roles of PI3Kgamma and its lipid products. Trends Cell Biol. 10, 466-473.
- Wang F. et al. 2002. Lipid products of PI(3)Ks maintain persistent cell polarity and directed motility in neutrophils. Nat. Cell Biol. 4, 513-518.
- Hoeller O. and Kay R.R. 2007. Chemotaxis in the absence of PIP3 gradients. Curr. Biol. 17, 813-817.
- Yang H.W. et al. 2016. Locally excitable Cdc42 signals steer cells during chemotaxis. Nat. Cell Biol. 18, 191-201.
- Cai D. et al. 2014. Mechanical feedback through E-cadherin promotes direction sensing during collective cell migration. Cell. 157, 1146-1159.
- Pankov R. et al. 2005. A Rac switch regulates random versus directionally persistent cell migration. J. Cell Biol. 170, 793-802.
- Plutoni C. et al. 2016. P-cadherin promotes collective cell migration via a Cdc42-mediated increase in mechanical forces. J. Cell Biol. 212, 199-217.
G-LISA Activation Assay Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
CYT社 BK124L 1 を参照 |
Rac1,2,3 G-LISA(R) Activation Assay Kit |
CYT | BK125 | 96 ASSAY |
¥317,000 |
Cdc42 G-LISA(R) Activation Assay Kit |
CYT | BK127 | 96 ASSAY |
CYT社 BK127L 1 を参照 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
CYT社 BK128L 1 を参照 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥317,000 |
Small G-Protein Activation Assays
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
CYT社 BK008L 1 を参照 |
Combo RhoA/Rac1/Cdc42 Activation Assay Kit |
CYT | BK030 | 1 KIT [3 x 10 assays] |
¥345,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034 | 1 KIT [50 assays] |
CYT社 BK034L 1 を参照 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036 | 1 KIT [80 assays] |
CYT社 BK036L 1 を参照 |
Live Cell Imaging Products
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥182,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥182,000 |
SiR-DNA Kit |
CYT | CY-SC007 | 1 KIT [50-300 slides] |
¥120,000 |
Rho Family Small G-Protein Tools
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Rho Activator |
CYT | CN01-A | 5*10 UNIT |
¥76,000 |
Rho Activator |
CYT | CN01-B | 20*10 UNIT |
¥268,000 |
Rac and Cdc42 Activator, Mouse |
CYT | CN02-A | 5*10 UNIT |
¥76,000 |
Rac and Cdc42 Activator |
CYT | CN02-B | 20*10 UNIT |
¥268,000 |
Rho Activator II |
CYT | CN03-A | 3*20 UG |
¥76,000 |
Rho Activator II |
CYT | CN03-B | 9*20 UG |
¥211,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-A | 1*20 UG |
¥73,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-B | 5*20 UG |
¥237,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-C | 20*20 UG |
お問い合わせ |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する