記事ID : 12483
ダイニン: 一つのモーターが関わる複数の神経変性疾患 CYTOSKELETON NEWS 2014年1月/2月号

ダイニン: 一つのモーターが関わる複数の神経変性疾患
細胞質ダイニン1(以下、ダイニン)は、1.6MDaのタンパク質複合体です。真核細胞では、微小管上を運動するモーターたんぱく質であり、ATPを加水分解して運動します(図1A)。さらにダイニンは、ミトコンドリアの移動、エンドソーム/リソソーム輸送、ミスフォールドタンパク質の分解誘導輸送、核のポジショニング、有糸分裂などの様々な細胞プロセスにとって不可欠です1-3(図2)。
ダイニン複合体は、〜530 kDaの2つの重鎖が、複数の中間鎖、中間軽鎖及び軽鎖と共に、ホモ二量体化した構造をとっています(図1A)。ホモ二量体を形成する重鎖の頭部は、微小管に沿って移動する際にエネルギーを提供する、ATPアーゼ活性を持っています。ダイニン複合体が輸送物質と結合したり、効率的な輸送を行うためには、偏在するダイニン結合タンパク質であるダイナクチン1-3(図1B)や、特定のアダプタータンパク質であるプレセニリン、LIS1、NUDEL、MuMA、Miro、Milton、BimL、BimELなどが必要です1-3。
軸索輸送の欠損やニューロン変性、運動異常、またはその他の神経欠損として現れるヒトの神経変性疾患には、ダイニン(またはダイナクチン)における変異が関係しているものがあります4-8(図1A、1B)。さらに、ダイニン機能障害や変異を持つ動物モデルは、ヒト患者と同様に、運動と神経の障害を示します3, 9-11(図1A)。このような症状で観察される、ニューロン欠損やタンパク質凝集、軸索輸送の欠損は、いずれも神経変性の病態生理学的な特徴です。ダイニンと様々な神経変性疾患との関連性について、さらなる研究が行われることが期待されています(図2)。

図1 細胞質ダイニン重鎖(A)とダイナクチンp150Glued (B)のドメイン構造
(A)ダイニンのドメイン構造。マウス/ヒト変異の位置、buttress(水色)、ストーク/微小管結合ドメイン (MTBD)(緑)、6 AAA ATPアーゼドメイン(青)、intra-dynein complex binding domains(ターコイズ)を含む。ヒト変異は、似た表現型を示すグループごとに色分けした(運動障害のみ[黄色]。他はすべて運動障害と脳の奇形があり[緑/青/赤] 、知能障害[緑、オレンジ、青、赤]、てんかん[緑]も見られる)。
(B)ダイナクチンp150Gluedの ドメイン構造。コイルドコイル(CC)、ダイニン/微小管(MT)結合ドメイン、ヒト変異の位置(すべて微小管結合ドメインにある)を含む。
参考文献3(A)、20(B)より修正改変した。スケールはアミノ酸番号を示す。
神経変性疾患
ダイニンについては、これまでも大脳基底核の神経変性疾患であるアルツハイマー病(AD)のような認知症、運動ニューロンの疾患である筋萎縮性側索硬化症(ALS)、脊髄性筋萎縮症(SMA)、球脊髄性筋萎縮症 (SBMA)といった疾患との関連性について、数々の研究がなされてきました2。
これまでに、ダイニンの機能に影響を与える少なくとも3つのダイニン変異 (Legs at odd angles [Loa]、Cramping1、Sprawling) が同定されています。これらのダイニン変異発現マウスは、運動と感覚ニューロンの両方、もしくはいずれかの欠損と、障害性の運動行動を示します3 ,10, 12-14(図1A)。これらの変異のうち、Loa変異(ダイニン重鎖の F580Y ポイントミューテーション)は、ダイニンとダイナクチンとの親和性だけでなく、発現や集合、ダイニン複合体を構成するタンパク質サブユニットの相互作用も変化させます15。Loa変異は、筋萎縮性側索硬化症(ALS)に関与しています。既報の文献によると、Cu/Zn superoxide dismutase enzyme(SOD1)を過剰発現させたALSモデルマウスは、Loa+ マウスと交配すると、運動ニューロンの死が遅くなり、寿命が延長しました16。さらに、Loa変異は、SOD1変異マウスに見られる軸索輸送の機能障害をレスキューしました3。Loaが介在してALSの表現型を改善するメカニズムについては、まだよくわかっていませんが、細胞ストレス関連タンパク質の逆行性輸送の減少、キネシン1の発現の変化、ミトコンドリアの活動と形態の変化、あるいはタウ発現の変化といった、複数の仮説が検討されています3。Cramping1は、運動行動や脂肪の代謝/貯蔵に異常が見られる、ダイニン重鎖のポイントミューテーション(Y1055C)です。Loaと同様に、in vivoモデルマウスを使った実験から、ハンチントン病との関連が考えられています13。さらに、このダイニン変異は、in vivoでは線条体の委縮を引き起こし、in vitroでは神経突起の形態を変化させます13。
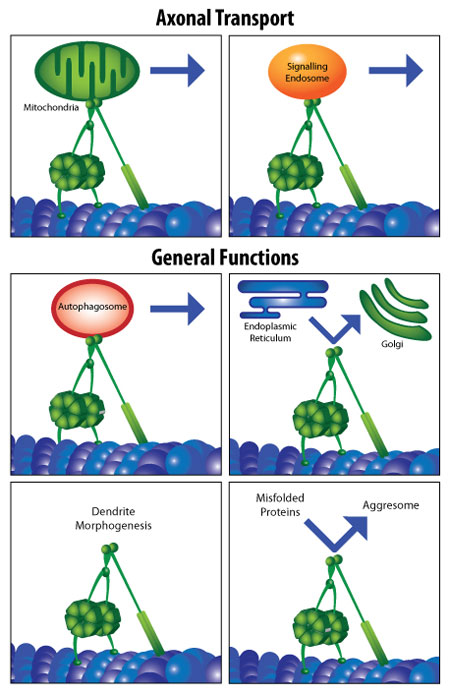
図2 ニューロンの軸索と細胞体におけるダイニンの機能(参考文献2より改修)
エンドサイトーシスの機能障害は、早期ADの病態を示すマーカーの一つであることが報告されており17,18、そのエンドサイトーシスの病態における役割により、ダイニンはアルツハイマー病(AD)にも関与していると考えられています。培養細胞において、RNA干渉によってダイニンの機能障害を誘導すると、老齢サル脳でみられるような、エンドサイトーシスの病態を示します。また、ダイニンをノックダウンすると、老人班の主要成分であるアミロイドβタンパク質を含む、アミロイド前駆体タンパク質とその切断生成物の蓄積が起こります19。このように、ダイニンが介在して起きるエンドサイトーシスでの変化が、早期ADの病態に重要な役割を果たしていることが示唆されています。
結論
様々な研究結果から、神経変性疾患の中には、その病態にダイニンの機能障害が強く関係するものがあると考えられます。しかし、ほとんどの研究が間接的な(すなわち相関的な)ものであることを考慮すると、その正確な役割は未解明であるといえます。したがって、正常と疾患の状態で、この逆行性のモーターが中枢神経において担う役割を解明するためには、ダイニンと関連するタンパク質複合体の役割について、さらなる研究が必要です。Cytoskeleton社は、カスタム精製した細胞質ダイニンをご提供し、またダイニン機能のインヒビターとエンハンサーの識別が可能なダイニンATPアーゼアッセイを開発しています。
参考文献
1. Allan V.J. 2011. Cytoplasmic dynein. Biochem. Soc. Trans. 39, 1169-1178.
2. Eschbach J. & Dupuis L. 2011. Cytoplasmic dynein in neurodegeneration. Pharmacol. Ther. 130, 348-363.
3. Schiavo G. et al. 2013. Cytoplasmic dynein heavy chain: the servant of many masters. Trends Neurosci. 36, 641-651.
4. Puls I. et al. 2003. Mutant dynactin in motor neuron disease. Nat. Genet. 33, 455-456.
5. Farrer M.J., et al. 2009. DCTN1 mutations in Perry syndrome. Nat. Genet. 41, 163-165.
6. Weedon M.N. et al. 2011. Exome sequencing identifies a DYNC1H1 mutation in a large pedigree with dominant axonal Charcot-Marie-Tooth disease. Am. J. Hum. Genet. 89, 308-312.
7. Harms M.B. et al. 2012. Mutations in the tail domain of DYNC1H1 cause dominant spinal muscular atrophy. Neurology. 78, 1714-1720.
8. Willemsen M.H. et al. 2012. Mutations in DYNC1H1 cause severe intellectual disability with neuronal migration defects. J. Med. Genet. 49, 179-183.
9. LaMonte B.H. et al. 2002. Disruption of dynein/dynactin inhibits axonal transport in motor neurons causing late-onset progressive degeneration. Neuron. 34, 715-727.
10. Hafezparast M. et al. 2003. Mutations in dynein link motor neuron degeneration to defects in retrograde transport. Science. 300, 808-812.
11. Kimura N. et al. 2012. Dynein dysfunction disrupts intracellular vesicle trafficking bidirectionally and perturbs synaptic vesicle docking via endocytic disturbances. Am. J. Pathol. 180, 550-561.
12. Chen X-J. et al. 2007. Proprioceptive sensory neuropathy in mice with a mutation in the cytoplasmic dynein heavy chain 1 gene. J. Neurosci. 27, 14515-14524.
13. Braunstein K.E. et al. 2010. A point mutation in the dynein heavy chain gene leads to striatal atrophy and compromises neurite outgrowth of striatal neurons. Hum. Mol. Genet. 19, 4385-4398.
14. Ori-McKenney K.M. et al. 2010. A cytoplasmic dynein tail mutation impairs motor processivity. Nat. Cell Biol. 12, 1228-1234.
15. Deng W. et al. 2010. Neurodegenerative mutation in cytoplasmic dynein alters its organization and dynein-dynactin and dynein-kinesin interactions. J. Biol. Chem. 285, 39922-39934.
16. Kieran D. et al. 2005. A mutation in dynein rescues axonal transport defects and extends the life span of ALS mice. J. Cell Biol. 169, 561-567.
17. Cataldo A.M. et al. 2004. Abeta localization in abnormal endosomes: association with earliest Abeta elevations in AD and Down syndrome. Neurobiol. Aging. 25, 1263-1272.
18. Nixon R.A. 2005. Endosome function and dysfunction in Alzheimer's disease and other neurodegenerative diseases. Neurobiol. Aging. 26, 373-382.
19. Kimura N. et al. 2009. Dynein dysfunction induces endocytic pathology accompanied by an increase in Rab GTPases. J. Biol. Chem. 284, 31291-31302.
20. Vallee R.B. et al. 2012. Multiple modes of cytoplasmic dynein regulation. Nat. Cell Biol. 14, 224-230.
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Dynein (Cytoplasmic), Porcine |
CYT | CS-DN01 | 1*50 UG |
¥153,000 |
MKLP2 motor domain (human recombinant), Human |
CYT | CS-MP05 | 1*50 UG |
CYT社 CSMP05A 1*50 を参照 |
KIF7 motor domain, Human |
CYT | CS-KF51 | 1*100 UG |
¥150,000 |
Myosin S1 Fragment (Cardiac), Bovine |
CYT | CS-MYS03 | 1*250 UG |
¥116,000 |
Skeletal Muscle Myosin S1, Rabbit |
CYT | CS-MYS04 | 1*250 UG |
¥120,000 |
Myosin S1 Fragment (smooth), Chicken |
CYT | CS-MYS05 | 1*250 UG |
¥120,000 |
Lyophilized Thin Filaments, Bovine |
CYT | CS-TFC01 | 1 MG [1 x 1 mg] |
販売終了 |
Tropomyosin/Troponin Complex, Bovine |
CYT | CS-TT05 | 1 MG [1 x 1 mg] |
CYT社 CSTT05A 1*1 を参照 |
CENP-E Motor domain (Hm.sap.) |
CYT | CP01-A | 2*25 UG |
¥150,000 |
Chromokinesin Motor Domain (Hm.sap.) |
CYT | CR01-A | 2*25 UG |
¥150,000 |
Eg5 Motor Domain (Hm.sap.) |
CYT | EG01-A | 2*25 UG |
¥150,000 |
BimC Motor Domain |
CYT | BM01-A | 2*25 UG |
¥133,000 |
Eg5 Homolog BimC Motor Domain Protein |
CYT | EG02-A | 2*15 UG |
¥137,000 |
KIFC3 Motor Domain (Hm.sap) |
CYT | KC01-A | 2*25 UG |
¥150,000 |
KIF3C Motor Domain (Hm.sap.) |
CYT | KF01-A | 2*25 UG |
¥150,000 |
KHC Motor Domain (Hm.sap.) |
CYT | KR01-A | 2*25 UG |
¥150,000 |
MCAK Motor Domain (Hm.sap.) |
CYT | MK01-A | 2*25 UG |
¥150,000 |
MKLP Motor Domain (Hm.sap.) |
CYT | MP01-A | 2*25 UG |
¥150,000 |
Kinesin ELIPA |
CYT | BK060 | 1 KIT [96 assays] |
¥278,000 |
HTS Kinesin ATPase Endpoint Assay |
CYT | BK053 | 1 KIT [1000 assays] |
¥307,000 |
Pre-formed Microtubles, Porcine |
CYT | MT002-XL | 1*10 MG |
お問い合わせ |
Pre-formed Microtubles, Porcine |
CYT | MT002-A | 4*500 UG |
¥153,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-A | 1*1 MG |
¥69,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-B | 5*1 MG |
¥240,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













