
記事ID : 33284
多能性幹細胞(PSC)での転写因子による翻訳後制御 CYTOSKELETON NEWS 2017年6月号

多能性幹細胞(PSC)での転写因子による翻訳後制御
多能性幹細胞(PSC)は、無制限に自己再生し、分化能力があることが特徴です。生体生物の器官のどんな細胞にも分化できる能力があることから、治療への応用が注目を集めています1。多能性幹細胞(PSC)は大きく分けて、胚性幹細胞(ESC)と人工多能性幹細胞(iPSC)の2種類があります。多能性幹細胞は、特定の細胞に分化するまで多能性を持ちます。幹細胞の多能性を保つには、多能性促進遺伝子を活性化する転写因子と、分化促進遺伝子を抑制する転写因子を選定する必要があります。これらの転写因子の発現レベルとトランス活性化能は、順番に翻訳後修飾(PTM)によって制御されています2,3。これらの主要な多能性転写因子は、Oct4, Sox2, Nanog3の3種です。これらの転写因子は互いに依存せずに機能できるうえ、Oct4については自己阻害能を持っていたり4、NanogがOct4/Sox2ヘテロダイマーによって、厳しく制御されたりすることもあることから5,6、転写制御の仕組みは複雑です。
PTMによってOct4, Sox2, Nanogの安定性(発現レベル)と転写活性(DNA結合親和性)が精密に制御されることを理解することは、幹細胞の恒常性の研究7に不可欠です。本稿では、Oct4, Sox2, Nanogといった多能性転写因子の活性が、ユビキチン化、SUMO化、リン酸化、メチル化、アセチル化などのPTMによって、いかにして制御されているかを考察します。
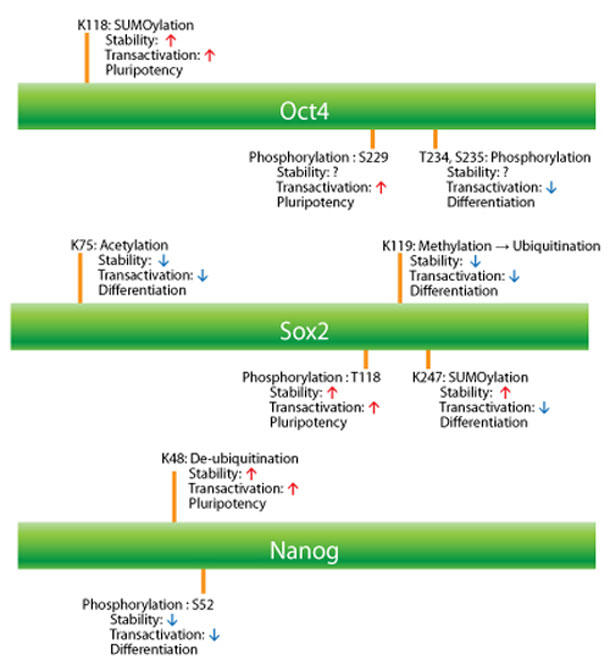
図1 Oct4, Sox2, Nanogによる翻訳後修飾(PTM)
様々なPTMが多能性転写因子の安定性と転写活性を制御しており、幹細胞が多能性を維持するか特定の細胞に分化するかを決定する。
Oct4のPTM制御
Oct4の発現レベルや転写活性は、ユビキチン化、SUMO化、リン酸化などのPTMにより制御されています。主にユビキチン化-プロテアソーム分解システムが制御されることで、細胞内のタンパク質発現の質とレベルが維持管理されています。Oct4のK63がwwp2 E3リガーゼによりユビキチン化されると、Oct4の発現レベルが低下し、胚性幹細胞は所定のタイプの細胞に分化するよう誘導されます7,8。Oct4の発現レベルだけではなく、転写活性もPTMが制御しています。Oct4のPit1-Oct-Unc86(POU)DNA結合ドメイン付近のK118がSUMO化されると、安定性とDNA結合親和性(トランス活性化能)9が著しく増加します(図1)。
Oct4はほかの転写因子とヘテロ二量体を形成したり、ホモ二量体を形成したりして、潜在的な転写活性を多様なものにしています10。プロテインキナーゼAによりSer229がリン酸化されると、Oct4ホモ二量体の配座がブロックされ、配列特異的なDNAへの結合が阻害されます11。さらに、ある未知のキナーゼによりPOU DNA結合ドメイン内でT234とS235の残基がリン酸化されると、Oct4の活性が低下します12(図1)。AblキナーゼによりY327残基がリン酸化されると、Oct4のDNA結合と転写活性に影響を及ぼす可能性はあるものの、まだ確証がありません12。
Sox2のPTM制御
胚性幹細胞におけるSox2の発現レベルはメチル化とリン酸化が拮抗することにより正確に制御されています13。メチルトランスフェラーゼSet7は、Sox2のK119をモノメチル化することで転写活性を阻害し、Sox2のユビキチン化を促進します(図1)。転写活性阻害とは逆に、AKT1によりT118がリン酸化されると、Sox2が安定化され、ユビキチン化-プロテアソーム経路が阻害されることで発現レベルが維持されます。Sox2の3つのセリン残基(S249、S250、S251)がリン酸化されると、K247でのSUMO化が促進されます14(図1)。
Oct4の場合とは異なり、Sox2はSUMO化されることで、DNA結合が阻害され、転写活性が低下します15。ストレス状況下では、SUMO化によってタンパク質が安定化され、タンパク質の核への輸送が増すことを考えると、リン酸化に依存するSUMO化は核輸送機構であるという認識は理にかなっているといえるでしょう16。ヒストンアセチルトランスフェラーゼ(p300/CBP)によりSox2のK75がアセチル化されると、ユビキチン介在性分解経路により、Sox2の核輸送と分解が促進されます17(図1)。
NanogのPTM制御
Nanogの複数のセリン残基がERK1によりリン酸化されることで、活性レベルが低下し、胚性幹細胞の分化が促進されます18。ERK1によりリン酸化されると、NanogはE3ユビキチンリガーゼFBXW8によってユビキチン化を受けやすくなり、安定性が低下します。逆に、ユビキチン特異的ペプチダーゼ21(USP21)が、胚性幹細胞のNanogと相互作用し、K48ユビキチン鎖に特異的な結合を脱ユビキチン化することで、Nanogの安定性を制御し、胚性幹細胞の多能性状態を維持します19(図1)。NanogについてはSUMO化の報告はまだありません。しかしながら、Nanogの発現は、Oct4やSox2のSUMO化によって相反する方向に制御されています。Oct4のSUMO化によりNanogの発現が上方制御され、Sox2のSUMO化によりNanogの発現が下方制御されます20。
まとめ
多能性転写因子の発現レベルとトランス活性化は、幹細胞を多能性にするか分化させるかを決定するもので、PTMにより厳密に制御されています。多能性の調整回路を微調整する仕組みとして、さまざまなPTMが、拮抗したり協力したりしながらOct4、Sox2、Nanogの活性を決定しています。したがって、個々の幹細胞のタンパク質マーカーのPTMを正確に同定することは、これらの転写因子がどのように互いに影響し合って幹細胞を制御しているかを理解するうえで非常に重要です。
Cytoskelton社では、研究者が幹細胞タンパク質のPTMを同定し、新規のPTMが介在する多能性転写因子の制御を解明するのに役に立つSignal Seeker™タンパク質濃縮キットをご用意しています。シンプルな幹細胞ライセートを利用して、多能性因子の翻訳後修飾の状態を明らかにすることができます。チロシンのリン酸化、ユビキチン化、SUMO化、アセチル化などのPTMを同定し定量することができます。
参考文献
- Trounson A. et al. 2016. Pluripotent stem cells progressing to the clinic. Nat. Rev. Mol. Cell Biol. 17, 194-200.
- Young R.A. 2011. Control of the embryonic stem cell state. Cell. 144, 940-954.
- De Los Angeles A. et al. 2015. Hallmarks of pluripotency. Nature. 525, 469-478.
- Pan G. et al. 2006. A negative feedback loop of transcription factors that controls stem cell pluripotency and self-renewal. FASEB J. 20, 1730-1732.
- Boyer L.A. et al. 2005. Core transcriptional regulatory circuitry in human embryonic stem cells. Cell. 122, 947-956.
- Rodda D.J. et al. 2005. Transcriptional regulation of nanog by OCT4 and SOX2. J. Biol. Chem. 280, 24731-24737.
- Cai N. et al. 2012. Post-translational modulation of pluripotency. J. Mol. Cell Biol. 4, 262-265.
- Xu H.M. et al. 2004. Wwp2, an E3 ubiquitin ligase that targets transcription factor Oct-4 for ubiquitination. J. Biol. Chem. 279, 23495-23503.
- Wei F. et al. 2007. Sumoylation of Oct4 enhances its stability, DNA binding, and transactivation. J. Biol. Chem. 282, 21551-21560.
- Reményi A. et al. 2003. Crystal structure of a POU/HMG/DNA ternary complex suggests differential assembly of Oct4 and Sox2 on two enhancers. Genes Dev. 17, 2048-2059.
- Saxe J.P. et al. 2009. Post-translational regulation of Oct4 transcriptional activity. PLoS One. 4, e4467.
- Brumbaugh J. et al. 2012. Phosphorylation regulates human OCT4. Proc. Natl. Acad. Sci. U.S.A. 109, 7162-7168.
- Fang L. et al. 2014. A methylation-phosphorylation switch determines Sox2 stability and function in ESC maintenance or differentiation. Mol Cell. 255, 537-551.
- Van Hoof D. et al. 2009. Phosphorylation dynamics during early differentiation of human embryonic stem cells. Cell Stem Cell. 5, 214-226.
- Tsuruzoe S. et al. 2006. Inhibition of DNA binding of Sox2 by the SUMO conjugation. Biochem. Biophys. Res. Commun. 351, 920-926.
- Geiss-Friedlander R. et al. 2007. Concepts in sumoylation: a decade on. Nat. Rev. Mol. Cell Biol. 8, 947-956.
- Baltus G.A. et al. 2009. Acetylation of sox2 induces its nuclear export in embryonic stem cells. Stem Cells. 27, 2175-2184.
- Kim S.H. et al. 2014. ERK1 phosphorylates Nanog to regulate protein stability and stem cell self-renewal. Stem Cell Res. 13, 1-11.
- Liu X. et al. 2016. USP21 deubiquitylates Nanog to regulate protein stability and stem cell pluripotency. Signal Transduct. Target. Ther. 1, e16024.
- Wu Y. et al. 2012. SUMOylation represses Nanog expression via modulating transcription factors Oct4 and Sox2. PLoS One. 7, e39606.
Signal Seeker™タンパク質濃縮キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
CYT社 BK160L 1 を参照 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
CYT社 BK161L 1 を参照 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
CYT社 BK162L 1 を参照 |
PTM 抗体、ビーズ、その他
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
CYT社 ASM24BEADSA 2*400 を参照 |
Ubiquitin Affinity Beads |
CYT | UBA01 | 40 RXN [4x420 ul] |
販売終了 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
CYT社 CIG01BEADS10 10 を参照 |
| Control for Ubiquitin Affinity Beads | CYT | CUB01 | 10 ASSAY |
販売終了 |
【商品情報】
- SUMO-2/3 アフィニティービーズ[CYT]
- 免疫沈降(IP)によるSUMO化タンパク質の濃縮に最適
Spirochrome™ Live Cell Imaging Probes
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥182,000 |
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥182,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥182,000 |
SiR700-Tubulin Kit |
CYT | CY-SC014 | 1 KIT [35-200 slides] |
¥182,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
SiR-DNA Kit |
CYT | CY-SC007 | 1 KIT [50-300 slides] |
¥120,000 |
SiR700-DNA Kit |
CYT | CY-SC015 | 1 KIT [35-200 slides] |
¥120,000 |
SiR-Lysosome Kit |
CYT | CY-SC012 | 1 KIT [50-300 slides] |
¥131,000 |
SiR700-Lysosome Kit |
CYT | CY-SC016 | 1 KIT [35-200 slides] |
¥131,000 |
【商品情報】
- Spirochrome プローブ(SiR700-Actin / SiR700-Tubulin / SiR700-DNA)[CYT]
- 細胞骨格(アクチン・チューブリン)やDNAを超解像度で蛍光観察 - Spirochrome プローブキット(SiR-Lysosome / SiR700-Lysosome)[CYT]
- 生細胞中のリソソームを far-red(遠赤色光)でイメージング
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













