紡錘体 - 可視化に向けた新規ツール CYTOSKELETON NEWS 2020年10月号

紡錘体について
細胞分裂はすべての生物において必要なプロセスです。このプロセスにおいて欠かせない部分が紡錘体の形成であり、有糸分裂期に活発かつ効率的にそれぞれの娘細胞へと染色体を分割する機構です。紡錘体の総体的な形態は、動原体微小管束(動原体線維とも呼ばれる)とともに詳細に明らかにされています。動原体微小管束は、中心体の極から伸びて動原体と呼ばれる姉妹染色分体上の特定化された付着部位に付着し、これにより分裂中期と後期に生ずるプロセスが完了します。紡錘体の総体的な形態が明らかになっている一方で、紡錘体機能を制御する分子機構の解明は以下のいくつかの理由により非常に困難です。
- 非常に大きく複雑で、通常、何百から何千もの微小管から構成されている
- 最も動的な細胞骨格構造の一つである
- 多数の微小管関連タンパク質(Microtubule-related proteins:MAPs)がこの構造の形成と機能に関与する 1, 2)
微小管は、チューブリンのad-heterodimerが付加されて形成されます。微小管の顕著な特性は動的不安定性であり、有糸分裂紡錘体形成および有糸分裂における微小管の役割などの、細胞内の多くの機能にとって重要です。微小管のもつ動的特性のため、微小管機能の研究は非常に困難とされていましたが、濁度測定、微分干渉顕微鏡(DIC顕微鏡)、および全反射照明顕微鏡(TIRF顕微鏡)と蛍光標識付チューブリンの組み合わせといった in vitroの手法により、微小管の成長速度、収縮速度、カタストロフ速度、およびレスキュー速度がより理解されるようになってきました3)。細胞内チューブリンを標識すると、その結合特性や関連タンパク質との相互関係、および動的制御に影響を及ぼす可能性があるため、細胞内微小管を研究すること自体が非常に困難なことと言えます。例えば、チューブリンに融合させた蛍光タンパク質を過剰発現させる一般的な方法は立体障害を生じ、全般的に高いバックグラウンドシグナルを生じてしまいます。この問題を回避し動的研究を進めるため、一定数の蛍光標識済みチューブリンを細胞内に微量注入したり、チューブリンの特定のイソ型上でのみGFPを発現させたりして、いくつかのチューブリンのみを蛍光標識する“スペックル”アプローチが用いられます。近年、SiRチューブリンと呼ばれる新規の蛍光標識済みチューブリン特異的プローブが、その特異性、細胞透過性、および蛍光特性により非常に注目されています4)。
本記事では、SiRチューブリン技術が紡錘体研究に役立つ3つの例を紹介します。
紡錘体力の理解
染色体を中期板へ凝縮し、分裂後期にそれらを分離するために、有糸分裂では特有の力が必要となります。いくつかの研究により、紡錘体で産生された力はモータータンパク質により産生されていることが示されています。近年、Novak M.氏らは、モータータンパク質のキネシン-5が、この力を産生するだけでなく紡錘体におけるトルクをも生み出していることを発見しました 5)。彼らは、誘導放出抑制(Stimulated emission depletion:STED)超分解能顕微鏡法をSiRチューブリンと共に利用し、中期紡錘体における微小管束の形態を観察し、微小管は線維束として並べられ曲線やS字型など様々な形状を示していると結論づけました。その後、PRC1-GFP融合タンパク質を用いて固定した細胞の動原体線維を標識し、共焦点顕微鏡により観察することで、z型が積み重なった動原体線維を再構築することができ、紡錘体は微小管束の左巻きの螺旋構造をもつキラルな物体であることを特定しました。また、キネシン-5がS-トリチル-L-システインにより不活化されていると、線維束の左巻き螺旋度が低減することも特定しました。トルク力が紡錘体形成と機能においてどのような役割を担うのか興味深いところです。
紡錘体の時空間的な組織化
紡錘体形成は、細胞骨格ネットワーク、分子モーター、および核によって調整されています。近年、Nunes氏らは、このプロセスを時空間的に研究し、紡錘体形成を効率よく確実に行うための複数の主要な機構を同定しました6)。彼らは高解像度イメージングと3D細胞再構築と組み合わせたマイクロパターニングを用いて、この複雑なプロセスを検討し、核膜が崩壊した際に中心体が最短の核軸へと配置されるよう分裂前期に再配向されることを特定しました。この配置は有糸分裂の忠実度にも影響を及ぼす可能性があるため、理解が非常に重要です。さらに、彼らはArp2/3と分子モーターの一種であるダイニンがこの中心体移動における主要な制御因子であることを見出しました。SiRチューブリンは、紡錘体形成チェックポイントが中心体配置に影響を受けているかどうかを判定する上で非常に重要な役割を担いました。この研究より、核軸から最短の場所に配置された中心体は、Mad2をより迅速に除去し、有糸分裂の進行を調整することを発見しました。
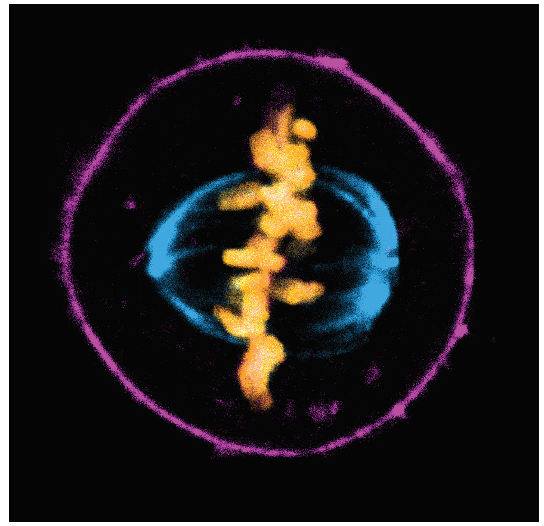
図1. SPY555-アクチン(紫色)、SPY595-DNA(橙色)、およびSPY650-チューブリン(青色)で標識した分裂HeLa細胞を93X STEDにより画像処理した。画像はSpirochrome社よりご提供頂いた。
動原体共役を制御する動原体タンパク質のリン酸化
動原体は有糸分裂における主要な構造体であり、有糸分裂期に動原体線維と活発に結合します。Long氏らは、分裂中期における重合および脱重合した微小管束と動原体との相互作用を制御する機構の解読に努めました7)。Hec1タンパク質は、動原体-微小管接着界面の主要な成分であり、AURORA Bキナーゼによりリン酸化される部位を有します。Long氏らは、Hec1が脱重合した微小管を掴んだまま、重合した微小管に沿って摩擦を生じることで、Hec1のリン酸化により重合した微小管束との相互作用能力が変わることを見出しました。Hec1リン酸化模倣による、微小管への相互作用性能の変化を明らかにすることを目的とした初期の研究では、SiRチューブリンが使用されました。
まとめと今後の課題
これらの研究では、紡錘体形成と機能をより明確にするため、紡錘体がいかに重要な役割を担うかに焦点を当て、SiRチューブリンプローブを既存のツールと組み合わせて使用しています。同様に、紡錘体において重要な機構を制御するMAPsにも焦点を当てています。MAPsはGreengard氏とその共同研究者によって1975年に初めて同定され8)、それ以降、複数のプロテオミクスおよび機能研究により紡錘体形成や機能に関与する200以上もの同様のタンパク質が同定されています1)。今後、超解像度顕微鏡を用いて紡錘体の動的制御におけるMAPsの役割をより深く追求するには、MAPs用のより良い生細胞画像化ツールが必要となります。GFP融合タンパク質は、既に確立されたアプローチですが、GFPによる光毒性やシグナル対ノイズ比が問題であり、特に蛍光プローブが好まれる単一分子や高解像度顕微鏡に対しては限定要因となります。代替の融合タンパク質システムとしてSNAPタグ標識システムがあり、これらタンパク質を一連のグルタミンベンジル(BG)抱合フルオロフォアと特異的に標識することができます9)。この方法を用いれば、頑強な蛍光色素を標識できる可能性がありますが、全てのBG-プローブが同等に作製されているわけではなく、近年の報告のひとつにこれらのプローブの多くは急速な光退色と非特異的染色を生ずることを示したものもあります 10)。
Cytoskeleton社では、人気の高いSiRとSPYチューブリンプローブ作製にも使用された、細胞透過性で蛍光色素にBGを抱合したBG-SiRおよびBG-SPY色素をご提供しています。特に、これらのプローブは高解像度顕微鏡との組み合わせで使うことができます(図1)。紡錘体研究に向けて、この新規ツールセットを利用することで、確立された細胞透過性かつ蛍光プローブを用いたチューブリンとMAPsの双方の標識が可能になります。
- Petry S. Mechanisms of Mitotic Spindle Assembly.Annu Rev Biochem. 2016;85:659-83.
- McIntosh JR. Mitosis. Cold Spring Harb Perspect Biol. 2016;8(9).
- Zwetsloot AJ, Tut G, Straube A. Measuring microtubule dynamics. Essays Biochem. 2018;62(6):725-35.
- Lukinavicius G, Reymond L, D'Este E, Masharina A, Gottfert F, Ta H, et al. Fluorogenic probes for live-cell imaging of the cytoskeleton. Nat Methods. 2014;11(7):731-3.
- Novak M, Polak B, Simunic J, Boban Z, Kuzmic B, Thomae AW, et al. The mitotic spindle is chiral due to torques within microtubule bundles. Nat Commun. 2018;9(1):3571.
- Nunes V, Dantas M, Castro D, Vitiello E, Wang I, Carpi N, et al. Centrosome-nuclear axis repositioning drives the assembly of a bipolar spindle scaffold to ensure mitotic fidelity. Mol Biol Cell. 2020;31(16):1675-90.
- Long AF, Udy DB, Dumont S. Hec1 Tail Phosphorylation Differentially Regulates Mammalian Kinetochore Coupling to Polymerizing and Depolymerizing Microtubules. Curr Biol. 2017;27(11):1692-9 e3.
- Sloboda RD, Rudolph SA, Rosenbaum JL, Greengard P. Cyclic AMP-dependent endogenous phosphorylation of a microtubule-associated protein. Proc Natl Acad Sci U S A. 1975;72(1):177-81.
- Keppler A, Gendreizig S, Gronemeyer T, Pick H, Vogel H, Johnsson K. A general method for the covalent labeling of fusion proteins with small molecules in vivo. Nat Biotechnol. 2003;21(1):86-9.
- Bosch PJ, Correa IR, Jr., Sonntag MH, Ibach J, Brunsveld L, Kanger JS, et al. Evaluation of fluorophores to label SNAP-tag fused proteins for multicolor single-molecule tracking microscopy in live cells. Biophys J. 2014;107(4):803-14.
New BG Substrates
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SPY555-BG Substrate, Abs./Em. 555/580 nm |
CYT | CY-SC204 | 35 NMOL |
¥119,000 |
SPY620-BG Substrate, Abs./Em. 619/635 nm |
CYT | CY-SC404 | 35 NMOL |
¥119,000 |
SiR650-BG Substrate, Abs./Em. 652/674 nm |
CYT | CY-SC504 | 35 NMOL |
¥119,000 |
SiR700-BG Substrate, Abs./Em. 696/718 nm |
CYT | CY-SC604 | 35 NMOL |
¥119,000 |
Fluorescent Tubulin Tools
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin, Porcine, 7-amino-4-methylcoumarin-3-acetic acid |
CYT | TL440M-A | 5*20 UG |
¥118,000 |
Tubulin, Porcine, 7-amino-4-methylcoumarin-3-acetic acid |
CYT | TL440M-B | 20*20 UG |
¥294,000 |
Tubulin, Porcine, HiLyte FluorTM 488 |
CYT | TL488M-A | 5*20 UG |
¥118,000 |
Tubulin, Porcine, HiLyte FluorTM 488 |
CYT | TL488M-B | 20*20 UG |
¥294,000 |
Tubulin, Porcine, Tetramethylrhodamine |
CYT | TL590M-A | 5*20 UG |
¥118,000 |
Tubulin, Porcine, Tetramethylrhodamine |
CYT | TL590M-B | 20*20 UG |
¥294,000 |
Tubulin, Porcine, HiLyte FluorTM 647 |
CYT | TL670M-A | 5*20 UG |
¥118,000 |
Tubulin, Porcine, HiLyte FluorTM 647 |
CYT | TL670M-B | 20*20 UG |
¥294,000 |
Live Cell Imaging Products
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥180,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-B | 10*20 UG |
¥98,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-C | 20*20 UG |
¥189,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する