
記事ID : 17149
翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する CYTOSKELETON NEWS 2016年7月号

翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
循環器疾患は、米国における死因の約3分の1を占めており、その大部分は心臓病です1。心臓病の病理学的検査では、心筋細胞(心臓の収縮および拍動を生み出す心臓の細胞)の死または機能障害が見られる場合が多くあります。心筋細胞の収縮機能の調節には、イオンチャネル/ポンプ、細胞骨格タンパク質、受容体などの多くのタンパク質や細胞機構が重要な役割を担っています。興味深いことに、これらのタンパク質の多くは、部分的に翻訳後修飾(PTM)を介して調節されています。翻訳後修飾(PTM)は、全体的な細胞応答の一部として、タンパク質を素早くかつ繊細に変化させることが可能です2。例えば、心不全を起こしたヒト心臓サンプルでは、重要な筋小胞体Ca2+/ATPアーゼ 2a (SERCA2a) のSUMO化が減少します3。興味深いことに、SERCA2a のSUMO化の回復は、心筋細胞の機能の修復に十分であることが示されており、SUMO化されたSERCA2a は治療介入のターゲットになり得ると考えられます。実際に、近年開発された低分子化合物である N106(SUMO活性化酵素 E1 リガーゼの活性化を介して SERCA2a のSUMO化を引き起こし、SUMO化を維持する)は、心不全を起こしたマウスの心室機能を改善します4。翻訳後修飾を受けたタンパク質が、心筋細胞の機能や心不全の進行に重要な役割を果たす例は、他にも多数報告されています2。本稿では、翻訳後修飾を受けた細胞骨格タンパク質が、心筋の収縮と心臓の正常な機能を促進する例を3つご紹介します。
微小管: α-チューブリン
微小管(MT)は、心筋細胞において、圧縮に対する抵抗成分としての機能、細胞内輸送の実行、収縮力を細胞内シグナルに変換することによるシグナル伝達の中継などの、複数の役割を担っています5。微小管は、α/ß-チューブリンからなるヘテロ二量体が重合して形成されます。特に、α-チューブリンのc末端領域は、グルタミン酸化、アセチル化、脱チロシン化などの多数の翻訳後修飾を受けています6。複数の研究で、チューブリンの翻訳後修飾がヒトの疾患の進行に関連することが示されています。α-チューブリンの脱チロシン化や、α-チューブリン尾部(C末端)のチロシン残基の切断は、特に注目されています。脱チロシン化は微小管ベースの機械的シグナル伝達に影響することから、この修飾を受けると細胞骨格の強度が増加し、心筋細胞の機能が変化します7。SiR-チューブリンを用いた高速でのサブ回折イメージングにより 、α-チューブリンの脱チロシン化は、微小管をサルコメアに固定して、収縮の際に微小管のバックリング(座屈)を調節するために重要であることが明らかにされています8(図1)。さらに、α-チューブリンの脱チロシン化は、肥大型/拡張型心筋症と診断された患者において優位に増加していましたが、アセチル化とグリコシル化は、微小管のバックリング(座屈)に特に重要な役割を果たしていませんでした8。心臓病において、どの翻訳後修飾が微小管の代替機能を調節しているのかを検討することは、大変興味深いです。
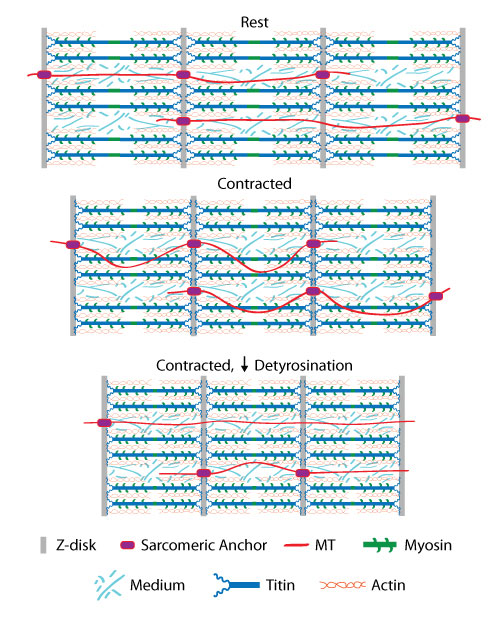
図1 静止状態で心筋細胞のサルコメア(筋節)に付着した微小管(MT)(A)。収縮に応答して微小管がバックリング(座屈)し、筋細胞の形状の変化に適応する(B)。微小管の脱チロシン化が減少すると、サルコメアへの付着が低下し、その結果、微小管はバックリング(座屈)せずに滑り込む(C)。
中間径フィラメント: デスミン
デスミンは、筋特異的に発現する中間径フィラメントタンパク質で、心筋細胞の収縮機構のための足場を形成します。デスミンの変異は、様々な心臓疾患において重要な役割を果たしており、デスミン心筋症(DRM: desmin-related myopathies)として分類されています5。デスミンは、リン酸化、ユビキチン化、ADP-リボシル化により、高度に翻訳後修飾されています9。重要なことに、デスミンの機能障害および筋関連疾患の進行に、これらの修飾が関与しています。例えば、絶食させたマウスの筋肉から調製した筋原線維では、デスミンがリン酸化されており、続いて起こるユビキチン化や分解のための目印となって、デスミンのタンパク質レベルを減少させます10。病態条件下の心筋細胞においてこの機構が生じるかどうかはわかっていませんが、他の研究で、心臓病においてデスミンのリン酸化による修飾が変化することが示されています11。デスミンは、翻訳後修飾により高度に修飾されていることから、翻訳後修飾のクロストークが、デスミンの発現や切断、および機能の調節においてどのような重要性を持つのかを検討することは、心臓病との関連性の面からも大変興味深いです。
トロポニン複合体: 心筋トロポニン I(cTnI)
トロポニン複合体(三量体)は、カルシウムによって活性を制御され、アクチンフィラメント上のトロポミオシンの位置を調節する、サルコメア(筋節)の収縮における重要な調節因子です。トロポニン複合体を構成する成分の一つである心筋トロポニン I(cTnI)は、サルコメアの収縮における重要な調節因子として機能し、分解されると血中に流出することから、心臓病の重要なバイオマーカーとなります12。心筋トロポニン I は、複数の部位でリン酸化されて、トロポニン複合体の形成や心筋細胞の機能に影響を与えると考えられていますが、ヒトの心臓病ではリン酸化の状態が変化することが報告されています12。心筋トロポニン I のその他の翻訳後修飾についてはほとんどわかっていませんが、ヒト心臓に由来する精製心筋トロポニン I を用いたプロテオミクス研究により、心筋トロポニン I がアセチル化、酸化、切断、リン酸化を受ける可能性があることが示されています13。しかし、この研究はゲル上のシングルバンドを用いて解析を行っており、ユビキチン化やSUMO化などの修飾を見落としている可能性があります。心臓病において、心筋トロポニン I の機能が翻訳後修飾によって調節されているかどうかは、ほとんどわかって(同定されて)いません。しかし、心筋トロポニン I は重要な疾患バイオマーカーであることから、翻訳後修飾についての研究は有意義であると考えられます。
まとめ
本稿では、翻訳後修飾が、細胞骨格タンパク質において重要な役割を担っており、広く調節に関わっていること、また、ヒトの健康および心不全などの疾患に対して重大な影響をもたらすことを説明しました。心臓病の潜在的な治療ターゲットとして、翻訳後修飾が注目を集めています。翻訳後修飾の新たなターゲットを同定するための新しいツールが開発されており、細胞骨格タンパク質を翻訳後修飾依存的に調節する新しいメカニズムの発見が期待されています。Cytoskeleton社の Signal Seeker™ キットは、翻訳後修飾を受けたタンパク質を生理条件下で解析することが可能で、疾患の進行における役割を検討するためにご利用いただけます。
参考文献
- Mozaffarian D. et al. 2016. Executive Summary: Heart Disease and stroke Statistics – 2016 Update. Circulation. 133, 447-454.
- Liddy K. et al. 2013. Functional decorations: post-translational modifications and heart disease delineated by targeted proteomics. Genome Med. 5, 20.
- Kho C. et al. 2011. SUMO1-dependent modulation of SERCA2a in heart failure. Nature. 477, 601-605.
- Kho C. et al. 2015. Small-molecule activation of SERCA2a SUMOylation for the treatment of heart failure. Nat. Commun. 6, 7229.
- Sequeria V. et al. 2014. The physiological role of cardiac cytoskeleton and its alterations in heart failure. Biochim. Biophys. Acta. 1838, 700-722.
- Magiera M. and Janke C. 2014. Post-translational modifications of tubulin. Curr. Biol. 24, R351-354.
- Kerr J. et al. 2015. Detyrosinated microtubules modulate mechanotransduction in heart and skeletal muscle. Nat. Commun. 6, 8526.
- Robison R. et al. 2016. Detyrosinated microtubules buckle and bear load in contracting cardiomyocytes. Science. 352, aaf0659.
- Capetanaki Y. et al. 2015. Desmin related disease: A matter of cell survival failure. Curr. Opin. Cell Biol. 32, 113-120.
- Cohen S. et al. 2012. Ubiquitylation by Trim32 causes coupled loss of desmin, Z-bands, and thin filaments in muscle atrophy. J. Cell Biol. 198, 575-589.
- Agnetti G. et al. 2014. Desmin modifications associate with amyloid-like oligomers deposition in heart failure. Cardiovasc. Res. 102, 24-34.
- Wijnker P.J.M. et al. 2014. Troponin I phosphorylation in human myocardium in health and disease. Neth. Heart J. 22, 463-469.
- Zabrouskov V. et al. 2008. Unraveling molecular complexity of phosphorylated human cardiac troponin I by top down electron capture dissociation/electron transfer dissociation mass spectrometry. Mol. Cell Proteomics. 7, 1838-1849.
Signal Seeker™ キット
[商品詳細]
- Signal-Seeker™ リン酸化チロシン濃縮キット
- 翻訳後修飾の解析に - Signal-Seeker™ ユビキチン化タンパク質濃縮キット
- 翻訳後修飾の解析に
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
¥239,000 |
抗体・アフィニティ―ビーズ
[商品詳細]
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥125,000 |
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥34,000 |
Anti Acetyl Lysine |
CYT | AAC01-BEADS | 2*200 UL |
販売終了 |
Anti Phosphotyrosine, (Mouse) , 27B10.4 |
CYT | APY03 | 2*100 UL |
CYT社 APY03 3*100 を参照 |
Anti Phosphotyrosine (Trial Size), (Mouse) , 27B10.4 |
CYT | APY03-S | 1*25 UL |
¥16,000 |
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti Phosphotyrosine, (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP | 1*100 UL |
¥141,000 |
Anti Phosphotyrosine (Trial Size), (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP-S | 1*25 UL |
¥47,000 |
Anti SUMO-2/3, (Mouse) , 12F3 |
CYT | ASM23 | 200 UL [2 x 100 μl] |
¥125,000 |
Anti SUMO 2/3 (Trial Size), (Mouse) , 12F3 |
CYT | ASM23-S | 25 UL [1 x 25 μl] |
¥34,000 |
Anti SUMO-2/3, (Mouse) , 11G2 |
CYT | ASM24 | 2*200 UL |
¥125,000 |
Anti SUMO-2/3 (Trial Size), (Mouse) , 11G2 |
CYT | ASM24-S | 1*150 UL |
¥45,000 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
¥197,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
¥125,000 |
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥34,000 |
精製アクチン
[商品詳細]
- アクチンタンパク質・アクチン結合タンパク質
- 細胞骨格研究に有用な高品質製品
その他のタンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Lyophilized Thin Filaments, Bovine |
CYT | CS-TFC01 | 1 MG [1 x 1 mg] |
販売終了 |
Tropomyosin/Troponin Complex, Bovine |
CYT | CS-TT05 | 1 MG [1 x 1 mg] |
¥78,000 |
Myosin S1 Fragment (Cardiac), Bovine |
CYT | CS-MYS03 | 1*250 UG |
¥109,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













