記事ID : 34545
Rab GTPase と 神経変性 CYTOSKELETON NEWS 2018年8月号

Rab GTPase と 神経変性
GTPaseのRasスーパーファミリーのメンバーであるRab GTPaseは、ヒトにおいて、少なくとも60のアイソフォームを発現し1、そのうち24のアイソフォームは、中枢神経系(CNS)に豊富に発現するか、特異的に発現します2。Rab GTPaseは、内膜系における小胞の形成、成熟、輸送、連結、および融合を調節する細胞内膜輸送の不可欠な調節因子です3。ニューロンにおいて、Rab媒介膜/小胞輸送は、ニューロン生理学の実質的なあらゆる局面に関与しており、その機能障害は、いくつかの神経変性疾患に関与しています2,4-7 (図.1)。事実、膜輸送の機能障害は、神経変性の初期マーカーとなります5。本稿では、パーキンソン病(PD)およびアルツハイマー病(AD)におけるRab媒介輸送の欠陥について概説いたします。
PDの原因は主に特発性であり、PD症例のほんの一部は家族性であり、またRab活性および膜輸送に関与するタンパク質の変異に起因します。変異タンパク質には、Rab39b、α-シヌクレイン、PTEN誘発推定キナーゼ(PINK1)、およびロイシンリッチリピートキナーゼ2(LRRK2)が含まれます4,6,7。Rab39b遺伝子の機能喪失変異が、レビー小体病理および知的障害の症状を伴う遺伝性の早期発症PDに直接関連するため、Rab39bは特に興味深いアイソフォームです8-10。Rab39bは、ニューロンにおいて選択的に発現し、海馬ニューロンのシナプス後膜へのAMPA受容体(AMPAR)サブユニットGluA2輸送を調節します4。Rab39bの変異は、未成熟シナプスおよび知的障害に関連するGluA2を欠くAMPARの形成をもたらします11,12。しかしながら、これらのAMPARがドーパミン作動性ニューロンの選択的変性にどのように寄与するかは未だ不明です4。α-シヌクレインは、PDの病理学的特徴の1つであるレビー小体を構成する細胞内タンパク質凝集体の主要成分です5,6,12。そして、α-シヌクレインは、膜輸送調節のために、Rab1,3a、5,7,8,11,13および35を含む複数のRabアイソフォームと相互作用し、共局在します(図.1)。
PDモデル( in vitro および in vivo )において、特定のRab(Rab1,3a、8,11,13)の過剰発現は、 変異体または野生型α-シヌクレインの過剰発現によるER / ゴルジ輸送障害や運動活性障害やドーパミンニューロン消失の一部または全てを逆転させます4,6,12。逆に、Rab35の過剰発現は、ドーパミンニューロンにおける変異型α-シヌクレインの凝集を増加させました4。Rab8a、8bおよび13は、PINK1活性化後にリン酸化されますが、PINK1自体はリン酸化されません13。Rab8のリン酸化は、PINK1のノックダウンまたは細胞株における変異によって妨げられます13。このことは、Rab8媒介のポストゴルジタンパク質輸送がPD患者のPINK1変異によって負の影響を受ける可能性があることを示唆しています4。LRRK2は、シナプス小胞のリサイクルおよびオートファジーに関与する哺乳類のキナーゼです14。LRRK2のショウジョウバエ相同体であるLrrkは、後期エンドソーム/リソソームに関連するアイソフォームであるRab7と直接相互作用し、調節します15。構造的に活性なLRRK2変異体は、早期から後期エンドソームへのRab7媒介タンパク質輸送を阻害し、Rab7の過剰発現はこの抑制を救済します16。LRRK2と相互作用する他のRabアイソフォームは、Rab3,5,8,10,12,32,35および38です4,6,7,17。 総合すると、これらの研究は、Rabが媒介する膜/小胞輸送のホメオスタシスを破壊する病原性変異タンパク質との間接的な関係を通じて、Rab GTPaseがPDの病因に関与することを強く示唆しています(図.1)。そして、特発性PDに直接関連する機能障害を有する単一のRabアイソフォームが存在するのか?または病因がRab媒介性膜輸送における一般的で広範な機能障害に起因するのか?という興味深い疑問が残ります7。
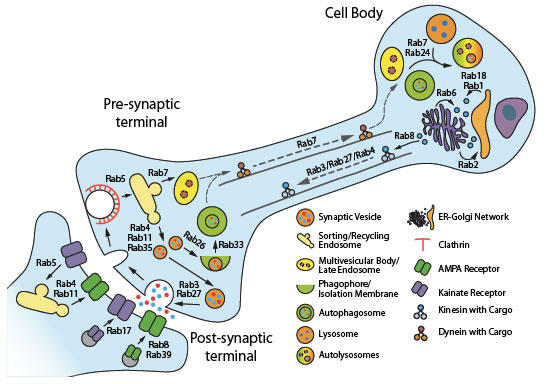
図.1 ニューロンにおけるRab GTPaseの機能(図は、文献4より引用)
PDと同様に、ADのほとんどの症例は特発性です。現在、アミロイドベータ(Ab)プラークおよび神経原線維変化の終局病態生理学や認知障害の発症に対して、Rab媒介性膜輸送欠陥の関与を究明している段階です。重要なことに、特発性ADにおけるAbの沈着に先立って、リソソーム内の欠陥が先行します。そして、AD発病の早期に起こるRab GTPaseの発現レベルおよび/または活性において、不均衡があると現在考えられています。初期のリソソーム内欠陥には、軽度の認知障害またはADと診断された患者の死後にコリン作動性前脳基底部および海馬ニューロンで観察されたRab5陽性の早期エンドソーム肥大やおよびリソソーム蓄積4やRab4,5,7および27 mRNAおよびタンパク質レベルのアップレギュレーションが含まれます18,19。これらの知見は、Rab媒介性エンドサイトーシス経路がADにおいて過剰に活性化され、Abおよびタウを含むタンパク質のプロセシング/輸送に悪影響を与えることを示唆しています。
プレセニリン1(PSEN1)、プレセニリン2(PSEN2)、およびアミロイド前駆体タンパク質(APP)の変異に関連する家族性ADについては、Rab媒介性リソソーム内シグナル伝達において同様の機構的変化が起こる可能性があります4,5。プレセニリンは、APPのプロセシング、病理学的Ab種の前駆体、タンパク質輸送およびターンオーバー(代謝回転)、およびオートファゴソーム/リソソーム機能に関与するプロテアーゼです4,5。機能的PSEN1は、Rab6の膜局在化によって達成される適切なRab6活性化に必要です。したがって、PSEN1の機能喪失は、ゴルジ体とERとの間のRab6媒介タンパク質輸送を損ないます20。また、活性型Rab GTPaseのレベル低下は、過剰な補償応答を引き起こし、Rab GTPaseの発現および/または機能の不均衡をさらに悪化させる可能性があります。例えば、AD患者では、Rab6発現レベルは5倍に増加し、PSEN1変異細胞ではRab4および6発現レベルが増加します4。逆に、PSEN1変異体を発現する細胞は、Rab8と膜の結合レベルの低下を示しました4。PSEN2は、後期エンドソーム/リソソームに特異的に局在しているため、Rab GTPアーゼはPSEN2と共同して働く可能性があり、そこでこれらの区画に輸送されるタンパク質を切断します4。この能力において、PSEN2変異体は、これらの区画における病理学的Abレベルの増加をもたらし、それによりエンドソーム/リソソーム機能を損ない、RabがAD病因に寄与する別の手段を提供するとも考えられています。
まとめ
PDおよびADにおいて、Rab GTPアーゼは、活性、調節および/または発現を変化させます。おそらく、Rabおよび神経変性の研究からの最も明白な教訓は、特定のRabアイソフォームが、PDおよびADにおける病理学的変異タンパク質の有害な効果を改善することができるため、Rab媒介活性、局在および発現レベルのバランス(すなわち、ホメオスタシス)を維持することが必須であるということであると同時に、他のRabアイソフォームで逆の効果が起こり得るということです。Rabホメオスタシスは、リソソーム内システムにおける初期の病原性変化を防ぐための鍵となります。特に、Rab GTPaseのリン酸化状態は、複数のキナーゼと直接的および間接的な相互作用を与えることも興味深い一面です。
Cytoskeleton社は、チロシンリン酸化、アセチル化、ユビキチン化、SUMO化を含む様々な翻訳後修飾(PTM)の内因性レベルを測定するためのSignal-Seeker™検出キットを提供し、研究者が目的タンパク質のPTMプロファイルを構築することを可能にします。
参考文献
- Brighouse A. et al. 2010. Rab protein evolution and the history of the eukaryotic endomembrane system. Cell. Mol. Life Sci. 67, 3449-3465.
- D’Adamo P. et al. 2014. RAB GTPases and RAB-interacting proteins and their role in the control of cognitive functions. Neurosci. Biobehav. Rev. 46, 302-314.
- Binotti B. et al. 2016. Functions of Rab proteins at presynaptic sites. Cells. 5, E7.
- Kiral F.R. et al. 2018. Rab GTPases and membrane trafficking in neurodegeneration. Curr. Biol. 28, R471-R486.
- Wang D. et al. 2013. Membrane trafficking in neuronal maintenance and degeneration. Cell. Mol. Life Sci. 70, 2919-2934.
- Shi M.-M. et al. 2017. Rab GTPases: The key players in the molecular pathway of Parkinson’s disease. Front. Cell. Neurosci. 11, 81.
- Clague M.J. and Rochin L. 2016. Parkinson’s disease: A traffic jam. Curr. Biol. 26, R332-R334.
- Wilson G.R. et al. 2014. Mutations in RAB39B cause X-linked intellectual disability and early-onset Parkinson disease with α-synuclein pathology. Am. J. Hum. Genet. 95, 729-735.
- Lesage S. et al. 2015. Loss-of-function mutations in RAB39B are associated with typical early-onset Parkinson disease. Neurol. Genet. 1, e9.
- Mata I.F. et al. 2015. The RAB39B p.G192R mutation causes X-linked dominant Parkinson’s disease. Mol. Neurodegener. 10, 50.
- Mignogna M.L. et al. 2015. The intellectual disability protein RAB39B selectively regulates GluA2 trafficking to determine synaptic AMPAR composition. Nat. Commun. 6, 6504.
- Tang B.L. 2017. Rabs, membrane dynamics, and Parkinson’s disease. J. Cell Physiol. 232, 1626-1633.
- Lai Y.-C. et al. 2015. Phosphoproteomic screening identifies Rab GTPases as novel downstream targets of PINK1. EMBO J. 34, 2840-2861.
- Shin N. et al. 2008. LRRK2 regulates synaptic vesicle endocytosis. Exp. Cell Res. 314, 2055-2065.
- Dodson M.W. et al. 2012. Roles of the Drosophila LRRK2 homolog in Rab7-dependent lysosomal positioning. Hum. Mol. Genet. 21, 1350-1363.
- Gomez-Suaga P. 2014. LRRK2 delays degradative receptor trafficking by impeding late endosomal budding through decreasing Rab7 activity. Hum. Mol. Genet. 23, 6779-6796.
- Steger M. et al. 2017. Systematic proteomic analysis of LRRK2-mediated Rab GTPase phosphorylation establishes a connection to ciliogenesis. eLife. 6, e31012.
- Ginsberg S.D. et al. 2010. Microarray analysis of hippocampal CA1 neurons implicates early endosomal dysfunction during Alzheimer’s disease progression. Biol. Psychiatry. 68, 885-893.
- Ginsberg S.D. et al. 2011. Upregulation of select rab GTPases in cholinergic basal forebrain neurons in mild cognitive impairment and Alzheimer’s disease. J. Chem. Neuroanat. 42, 102-110.
- Scheper W. et al. 2004. Rab6 membrane association is dependent of Presenilin 1 and cellular phosphorylation events. Mol. Brain Res. 122, 17-23.
Signal Seeker™ Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥121,000 |
PTM Antibodies, Beads, Etc
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Mouse)  |
CYT | AAC02 | 2*100 UL |
¥125,000 |
Anti Acetyl Lysine (Mouse)  |
CYT | AAC03 | 2*100 UL |
¥125,000 |
Anti Acetyl Lysine (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP | 1*100 UL |
¥141,000 |
Anti Acetyl Lysine Affinity Beads (Mouse)  |
CYT | AAC04-BEADS | 4*500 UL |
¥197,000 |
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti Phosphotyrosine, (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP | 1*100 UL |
¥141,000 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
¥197,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
¥125,000 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
¥34,000 |
Control for Acetyl- immunoprecipitation IgG beads |
CYT | CIG02-BEADS | 10 ASSAY |
¥34,000 |
Control for Ubiquitin Affinity Beads |
CYT | CUB02-BEADS | 10 ASSAY |
CYT社 CUB02BBEADS 10 を参照 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する














