
記事ID : 12644
ミオシンのアセチル化はサルコメアの構造と機能を調節する CYTOSKELETON NEWS 2014年5月号

ミオシンのアセチル化はサルコメアの構造と機能を調節する
サルコメア複合体は、カルシウム感受性で、筋細胞において機械化学的な変換ユニットとして重要な役割を果たしています。ミオシン、アクチン、トロポミオシン、3種類のトロポニンを含みます。そのうちの1つであるトロポニンCは、カルシウムが結合すると、ミオシンとF-アクチンの結合を促進します。サルコメアの機能を制御しているカルシウムレベルは、筋小胞体の RyR2 受容体チャネルで発生する電気信号によって起こる、カルシウム流入によって変動します1。他に、サルコメアの構成要素をリン酸化する、ミオシン軽鎖キナーゼ[MLCK]、ミオシン軽鎖2[MLC2]、cAMP依存性プロテインキナーゼ[PKA]などのキナーゼによっても制御されています2,3。近年は、アセチル化、メチル化、酸化、ユビキチン化などによる調節も報告されています4,5。前臨床研究や肥大性心疾患の治療に、ヒストン脱アセチル化酵素(HDAC)阻害剤が使用されていること6,7や、正しくサルコメアが機能するためには、ミオシンのアセチル化されたアミノ酸が重要であるという報告8,9から、近年、アセチル化がさらに重要であると考えられています。
Mahesh Gupta の研究グループは、心機能における HDAC 阻害剤の研究を通して、サルコメアの機能にアセチル化が重要であることを示しました。報告によると、ヒストンアセチルトランスフェラーゼ(HAT; p300/CBP-associated factor [PCAF])と HDAC(HDAC4)の両方がサルコメアマトリックスに局在し、HDAC 阻害剤で処理した筋フィラメントでは力発生が増加します8。2011年には、別の HDAC(HDAC3)も心臓のサルコメアに結合していることを示しました9。また、広範に認識する抗アセチル化抗体を使用して、アセチル化タンパク質の一つがミオシンであることを示しました。近年、Foster ら10が、ブタ心臓タンパク質の初期アセチル化タンパク質を解析した結果、240 のタンパク質中 994のリジン残基が修飾され、ミオシンの多くのリジン残基がアセチル化されていたと報告しました。実際、49 のアセチル化リジン残基を持つミオシンは、最もアセチル化されているタンパク質です10。ミオシンのリジン残基は、コイルドコイル、ヒンジ領域およびアクチン結合部位でアセチル化されています(図1参照)。
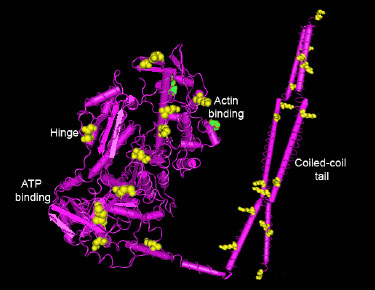
図1 ミオシン構造略図および報告されているアセチル化部位
Foster ら10が発見したリジン残基を黄色、Samant ら9を緑色で示す。アセチル化は、アクチンやATPの結合部位からヒンジ領域・コイルドコイルまで、ミオシンの重要な機能領域の全てをカバーしている。
ミオシンは、心筋細胞におけるアセチル化のターゲットとして特出しており、多くの研究グループによって生化学的および機能的な研究が行われています。In vitro において、PCAF HAT を用いてミオシンをアセチル化すると、2つのリジン残基(K549 と K633)がアセチル化されることが明らかとなりました。どちらも頭部ドメイン内で、アクチン結合部位(K549)または力発生に関わるヒンジ領域(K633)に隣接しており、ミオシンの重要な機能に影響を与える位置に配置されています9。K549 の修飾は、in vivo のサンプルにおいても確認されましたが、K633 の修飾は、in vivo では検出されませんでした。in vitro で、修飾されたミオシンを調製して酵素反応解析を行うと、Km(ミカエリス定数)は 30% 低下、アクチンフィラメントの運動性は 20-36% 増加しており、in vivo における機能的な活性に、かなり影響を与えている可能性があります。このような実験では、酵素反応速度論や、特異的に修飾されたアミノ酸部位の定量的な測定について、より詳細な解析が求められます。
心臓ストレス/機能障害モデル(大動脈狭窄・6週間)において、ミオシンのアセチル化はコントロールの10倍以上に増加することが示されています9。また、イソプロテレノール(肥大アゴニスト)を使用した実験では、ストレスによるアイソフォーム発現の変化や肥大に先立って、アセチル化が3日間で30%増加しました。これらの結果は、ミオシンのアセチル化が急速に起こり、機械的に効率を向上させるような変化を引き起こすことを示唆しています。
興味深いことに、Foster ら10による全体のアセチル化タンパク質を検出する方法や、他のグループがそれぞれ異なる組織を用いて行った方法などからは、Gupta 博士の研究室が報告した2つのアセチル化リジンは検出されませんでした。これは広範なアセチル化研究においては一般的で、異なる報告から検出されたアセチル化ペプチドが有意に重複している(30-60%)こともあれば、重要な新発見があることもあります。このことは、おそらく新たな研究分野や異なる方法論を採用した結果であると考えられますが、まだ全ては解明されていません。アセチル化の割合を決定すること、広範で特異的な配列を認識する新しい抗体、特定のアミノ酸を特異的にアセチル化する技術などは、今後の実験や方法論の構築に役立つと考えられます。
Cytoskeleton 社では、アセチル化研究に役立つ新しいモノクローナル抗体(品番: AAC01)を販売しています。他の抗アセチル化抗体に比べてユニークな配列を認識し、アセチル化ミオシンを簡単に検出することが可能です。
参考文献
1. Song L.S. et al. 2005. Calcium biology of the transverse tubules in heart. Ann. N.Y. Acad. Sci. 1047, 99-111.
2. Seguchi O. et al. 2007. A cardiac myosin light chain kinase regulates sarcomere assembly in the vertebrate heart. J. Clin. Invest. 117, 2812-24.
3. Sumandea C.A. 2011. Cardiac troponin T, a sarcomeric AKAP, tethers protein kinase A at the myofilaments. J. Biol. Chem. 286, 530-541.
4. Cui Z. et al. 2013. Regulation of cardiac proteasomes by ubiquitination, SUMOylation, and beyond. J. Mol. Cell Cardiol. doi: 10.1016/j.yjmcc.2013.10.008.
5. Terman J.R. and Kashina A. 2013. Post-translational modification and regulation of actin. Curr. Opin. Cell Biol. 25, 30-38.
6. Ling S. et al. 2012. CKIP-1 inhibits cardiac hypertrophy by regulating class II histone deacetylase phosphorylation through recruiting PP2A. Circulation. 126, 3028-40.
7. Kook H. et al. 2003. Cardiac hypertrophy and histone deacetylase-dependent transcriptional repression mediated by the atypical homeodomain protein Hop. J. Clin. Invest. 112, 863-71.
8. Gupta M.P. et al. 2008. HDAC4 and PCAF bind to cardiac sarcomeres and play a role in regulating myofilament contractile activity. J. Biol. Chem. 283, 10135-10146.
9. Samant S.A. et al. 2011. HDAC-3 dependent reversible lysine acetylation of cardiac myosin heavy chain isoforms modulates their enzymatic and motor activity. J. Biol. Chem. 286, 5567-5577.
10. Foster D.B. et al. 2013. The cardiac acetyl-lysine proteome. PLoS One. 8, e67513.
抗アセチル化リジン抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥125,000 |
ミオシン/アクチン キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
F-Actin Visualization Biochem Kit |
CYT | BK005 | 1 KIT [300 slides] |
¥133,000 |
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
Actin Binding Protein Spin-down Biochem Kit (for muscle) |
CYT | BK001 | 1 KIT [30-100 assays] |
¥254,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥257,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
F-Actin Visualization Biochem Kit |
CYT | BK005 | 1 KIT [300 slides] |
¥133,000 |
ATPase ELIPATM (Enzyme Linked Inorganic Phosphate Assay) |
CYT | BK051 | 1 KIT [96 assays] |
¥127,000 |
CytoPhosTM Phosphate Assay (1-500ug/ml protein reactions) |
CYT | BK054 | 1 KIT [1000 assays] |
¥127,000 |
GTPase ELIPATM (Enzyme Linked Inorganic Phosphate Assay) |
CYT | BK052 | 1 KIT [96 assays] |
¥127,000 |
Kinesin ELIPA |
CYT | BK060 | 1 KIT [96 assays] |
¥263,000 |
HTS Kinesin ATPase Endpoint Assay |
CYT | BK053 | 1 KIT [1000 assays] |
¥291,000 |
ミオシン/アクチン タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-A | 4*250 UG |
¥68,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-C | 5*1 MG |
¥166,000 |
Actin Protein (skeletal muscle, >95% pure), Rabbit, Unlabeled |
CYT | AKL95-B | 1*1 MG |
¥32,000 |
Actin Protein (skeletal muscle, >95% pure), Rabbit, Unlabeled |
CYT | AKL95-C | 5*1 MG |
¥128,000 |
Actin Protein (cardiac muscle, >99% pure), Bovine, Unlabeled |
CYT | AD99-A | 1*1 MG |
¥40,000 |
Actin Protein (cardiac muscle, >99% pure), Bovine, Unlabeled |
CYT | AD99-B | 5*1 MG |
¥171,000 |
Actin Protein, smooth muscle, >99% pure |
CYT | AS99-A | 1*1 MG |
¥40,000 |
Actin Protein, smooth muscle, >99% pure |
CYT | AS99-B | 5*1 MG |
¥171,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-A | 2*250 UG |
¥74,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-E | 5*1 MG |
お問い合わせ |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-A | 1*1 MG |
¥63,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-B | 5*1 MG |
¥227,000 |
Lyophilized Thin Filaments, Bovine |
CYT | CS-TFC01 | 1 MG [1 x 1 mg] |
販売終了 |
Myosin S1 Fragment (Cardiac), Bovine |
CYT | CS-MYS03 | 1*250 UG |
¥109,000 |
Skeletal Muscle Myosin S1, Rabbit |
CYT | CS-MYS04 | 1*250 UG |
¥113,000 |
Myosin S1 Fragment (smooth), Chicken |
CYT | CS-MYS05 | 1*250 UG |
¥113,000 |
Myosin Skeletal Muscle, Rabbit, Unlabeled |
CYT | MY02-A | 5*1 MG |
¥109,000 |
Myosin Skeletal Muscle, Rabbit, Unlabeled |
CYT | MY02-B | 20*1 MG |
¥318,000 |
Myosin Cardiac Muscle |
CYT | MY03-A | 5*1 MG |
¥109,000 |
Myosin Cardiac Muscle |
CYT | MY03-B | 20*1 MG |
¥318,000 |
Myosin: Heavy Meromyosin, Rabbit, Unlabeled |
CYT | MH01-A | 4*50 UG |
¥95,000 |
Tropomyosin/Troponin Complex, Bovine |
CYT | CS-TT05 | 1 MG [1 x 1 mg] |
¥78,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













