記事ID : 11963
神経変性:Rhes、SUMO化、ハンチントン病 CYTOSKELETON NEWS 2013年10月号

神経変性:Rhes、SUMO化、ハンチントン病
低分子量Gタンパク質のRhes(Ras Homolog Enriched in Striatum)は、266アミノ酸のタンパク質で、主に線条体と大脳皮質の一部で見られます(Falk et al., 1999)。脳及び身体全体で、多くの細胞種が野生型及び変異型のハンチンチンタンパク質(mHTT)を発現している一方で、線条体ニューロン(及び皮質ニューロンの一部)がハンチントン病(HD)では選択的に傷つきやすくなっているという、逆説的な発見を理解するのに、Rhesが重要であることが、最近の研究により明らかになってきました(Harrison, 2012; Harrison and LaHoste, 2013)。
HDは、ハンチンチン遺伝子中にCAGリピートを35回以上含むという特徴を持つ、常染色体優性神経変性障害で、複数のグルタミン残基(別名 ポリグルタミン又はポリQリピート)を含むmHTTの発現を引き起こします。HDは、不治で治療不能の病気であり、運動、認知力、感情のコントロールに障害が起こります。変異タンパク質(mHTT)は、脳や抹消組織全体の細胞に遍在的に発現しているにも関わらず、線条体及び皮質においてmHTTを発現する神経細胞だけが選択的に欠損します。(Harrison, 2012; Harrison and LaHoste, 2013)。mHTTは、神経細胞中で2種類の形で存在しています。1つは、可溶性の毒性モノマー、もう1つはタンパク質を隔離する凝集体又は封入体です。この不溶性の凝集体は、神経保護性と考えられています(Saudou et al., 1998; Gong et al., 2008; Lu and Palacino, 2013)(図1)。mHTTは、SUMO化を含む複数の翻訳後修飾(PTM)を受けます。このPTMが封入体の脱凝集を引き起こし、可溶性のmHTTモノマーを放出させ、神経毒性を増加させます(Steffan et al., 2004)(図1)。
重要なことに、mHTTの発現は、単独ではHDの病理を引き起こすことはありません(Zeron et al., 2002; Okamoto et al., 2009)。mHTTが誘導する神経変性の媒介に関わっているその他のタンパク質又はシグナル経路が存在するのです。Rhesが野生型のHTTよりも変異型HTTに優先的に結合し、in vitroにおいて、SUMO E3 リガーゼとして機能してmHHTをSUMO化させることが発見されたことにより、HDの研究は大きく進展しました(Subramaniam et al., 2009)(図1)。RhesによるmHTTのSUMO化は、封入体の脱凝集及び/又は封入体の減少により、可溶性mHTTを増加させ、mHTTが媒介する神経毒性を増強します(Subramaniam et al., 2009)。Rhesもまたそれ自身がSUMO化を受けます(Subramaniam et al., 2009)。
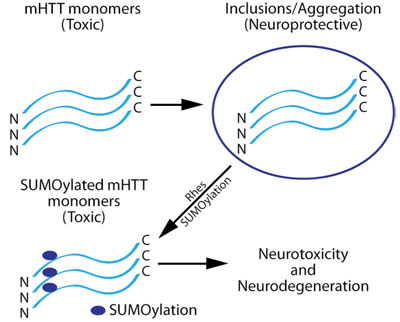
図1
神経細胞におけるmHTTタンパク質のプロセシングと、Rhesによる修飾で、神経毒性及び神経変性が引き起こされる
予想されるように、Rhes及びmHTTタンパク質の共発現がニューロンの生存活性を下げる一方、HDのin vitroニューロンモデルにおいて、Rhes遺伝子をサイレンシングすることにより、mHTTが媒介する神経毒性から細胞は保護されました(Seredenina et al., 2011)。興味深いことに、mHTTは、RhesによるSUMO化の唯一のターゲットタンパク質ではなく、RhesはSUMO化酵素E1及びUbc9との間のクロスSUMO化を増強しており、Rhesノックアウトマウスでは、線条体におけるSUMO化のレベルが全体的に低下しました(Subramaniam et al., 2010)。
HDトランスジェニックマウスモデルにRhesのノックアウトをクロスさせることで、HDにおけるRhesの役割はin vivoでも確認されています。このダブルトランスジェニックマウスは、HDに関連する症状の発病が著しく遅く、程度も低いという結果でした(Baiamonte et al., 2013)。同様に、線条体特異的なin vivo HDモデルは、Rhesノックアウトマウスでは再現しませんでした(Mealer et al., 2013)。この発見により、Rhesの欠損が、正常マウスではHDを引き起こす処置で誘発される細胞死及び運動障害から、ニューロンを保護していることが実証されました(Mealer et al., 2013)。
線条体ニューロンの選択的な神経変性を媒介するメカニズムの研究は、シナプス外NMDAレセプターに対するシナプスの差別的な活性化に集中しています(Okamoto et al., 2009)。この研究でも、NMDAレセプター媒介mHTT神経毒性におけるRhesの役割に光が当たりました。シナプスNMDAレセプターの活性が、mHTTの封入体の形成に必要で、実際に促進していることが発見されました(Okamoto et al., 2009)。mHTTの存在は、野生型のHTTに比べて、興奮毒性障害に対するニューロンの脆弱性を増加させました(Zeron et al., 2002; Okamoto et al., 2009)。シナプス外NMDAレセプターの妨害は、mHTT発現ニューロンを、興奮毒性から保護します(Okamoto et al., 2009)。この神経保護効果は、シナプス外NMDAレセプターのブロックによるRhesタンパク質レベルの低下としてRhesに関連しており、シナプス外NMDAレセプターが刺激を受けているときには、mHTT媒介神経毒性におけるRhesレベルが上昇することと関係しています(Okamoto et al., 2009)。これらの発見により、HDの影響を受けやすいニューロンを保護するために、シナプス外NMDAレセプターの選択的なブロックを、有益な治療法として用いることが提案されています。
GTPaseを含むタンパク質のPTMを研究するためのツールが更に利用できるようになり、細胞の生理学的及び病理学的プロセスは更に理解されるようになるでしょう。PTMを研究するツールは、神経科学、心臓学、腫瘍学において、前臨床及び臨床研究の両方に有用です。
参考文献
1. Falk J.D., Vargiu P., Foye P.E., Usui H., Perez J. et al. 1999. Rhes: A striatalspecific Ras homolog related to dexras1. J. Neurosci. Res. 57, 782-788.
2. Harrison L.M. 2012. Rhes: A GTP-binding protein integral to striatal physiology and pathology. Cell Mol. Neurobiol. 32, 907-918.
3. Harrison L.M. and LaHoste G.J. 2013. The role of Rhes, Ras homolog enriched in striatum, in neurodegenerative processes. Exp. Cell Res. 319, 2310-2315.
4. Saudou F., Finkbeiner S., Devys D., and Greenberg M.E. 1998. Huntingtin acts in the nucleus to induce apoptosis but death does not correlate with the formation of intranuclear inclusions. Cell. 95, 55-66.
5. Gong B., Lim M.C., Wanderer J., Wyttenbach A., and Morton A.J. 2008. Time-lapse analysis of aggregate formation in an inducible PC12 cell model of Huntington’s disease reveals time-dependent aggregate formation that transiently delays cell death. Brain Res. Bull. 75, 146-157.
6. Lu B. and Palacino J. 2013. A novel human embryonic stem cell-derived Huntington’s disease neuronal model exhibits mutant huntingtin (mHTT) aggregates and soluble mHTT-dependent neurodegeneration. FASEB J. 27, 1820-1829.
7. Steffan J.S., Agrawal N., Pallos J., Rockabrand E., Trotman L.C. et al. 2004. SUMO modification of huntingtin and Huntington’s disease pathology. Science. 304, 100-104.
8. Zeron M.M., Hansson O., Chen N., Wellington C.L., Leavitt B.R., et al. 2002. Increased sensitivity to N-Methyl-D-Aspartate receptor-mediated excitotoxicity in a mouse model of Huntington’s disease. Neuron. 33, 849-860.
9. Okamoto S., Pouladi M.A., Talantova M., Yao D., Xia P. et al. 2009. Balance between synaptic versus extrasynaptic NMDA receptor activity influences inclusions and neurotoxicity of mutant huntingtin. Nat. Med. 15, 1407-1413.
10. Subramaniam S., Sixt K.M., Barrow R., and Snyder S.H. 2009. Rhes, a striatal specific protein, mediates mutant huntingtin cytotoxicity. Science. 324, 1327-1330.
11. Seredenina T., Gokce O., and Luthi-Carter R. 2011. Decreased striatal RGS2 expression is neuroprotective in Huntington’s disease (HD) and exemplifies a compensatory aspect of HD-induced gene regulation. PLoS ONE. 6:e22231.
12. Subramaniam S., Mealer R.G., Sixt K.M., Barrow R.K., Usiello A., et al. 2010. Rhes, a physiologic regulator of sumoylation, enhances cross-sumoylation between the basic sumoylation enzymes E1 and Ubc9. J. Biol. Chem. 285, 20428-20432.
13. Baiamonte B.A., Lee F.A., Brewer S.T., Spano D., and LaHoste G.J. 2013. Attenuation of Rhes activity significantly delays the appearance of behavioral symptoms in a mouse model of Huntington’s disease. PLoS ONE. 8:e53606.
14. Mealer R.G., Subramaniam S., and Snyder S.H. 2013. Rhes deletion is neuroprotective in the 3-nitropropionic acid model of Huntington’s disease. J. Neurosci. 33, 4206-4210.
関連研究ツール キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
Rho GAP Assay Kit (non-radioactive) |
CYT | BK105 | 1 KIT [80-160 assays] |
¥227,000 |
RhoGEF Exchange Assay |
CYT | BK100 | 1 KIT [60-300 assays] |
¥227,000 |
Raf protein ras binding domain on GST beads, Mouse |
CYT | RF02-A | 1*2 MG |
CYT社 RF02A 2*2 を参照 |
Raf protein ras binding domain on GST beads, Mouse |
CYT | RF02-B | 4*2 MG |
CYT社 RF02B 6*2 を参照 |
Gタンパク質モジュレーター及びビーズ
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Rac and Cdc42 Activator, Mouse |
CYT | CN02-A | 5*10 UNIT |
¥71,000 |
Rac and Cdc42 Activator |
CYT | CN02-B | 20*10 UNIT |
¥254,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-A | 1*20 UG |
¥68,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-B | 5*20 UG |
¥224,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-C | 20*20 UG |
お問い合わせ |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













