記事ID : 15114
Ras 依存性の癌で注目される YAP1 CYTOSKELETON NEWS 2015年4月号

Ras 依存性の癌で注目される YAP1
YAP1 と Hippo 経路
シグナル伝達経路の一つである Hippo 経路は、細胞運命の協調的な調節を介して、器官のサイズの制御に重要な役割を果たしています1。Hippo 経路のコアコンポーネントを形成する2種類のセリン/スレオニンキナーゼ(MST1/2 および LATS1/2)は、転写共役因子 YAP および TAZ をリン酸化することで「不活性化」し、細胞増殖のシグナル伝達を連続的にシャットダウンします2,3(図1)。YAP および TAZ はパラロガスな関係にあるタンパク質(重複しているが同一ではない)で、細胞増殖、分化、アポトーシスを調節します4。本稿では特に YAP1 に注目しますが、YAP1 に関する考察の大部分は TAZ にも当てはまることが示されています。MST1/2 — LATS1/2 — YAP1 シグナル伝達系は、細胞外環境(細胞接着、細胞外マトリックスの硬さなど)の物理的な変化に対する細胞応答の結果として活性化されます5。数種類のシグナル伝達経路が Hippo 経路と交差しており、最終的に YAP1 活性を制御します6。Hippo 経路が活性化されると、LATS1/2 によって YAP1 の複数のセリン残基(S61、S109、S127、S164、S381)がリン酸化され、リン酸化された S127 に 14-3-3 が結合することによって YAP1 を細胞質に保持します3。また、S381 のリン酸化により CK1δ/εが結合し、さらにセリンがリン酸化(S384、S387)されることで、YAP1 と SCFbTRCP ユビキチンリガーゼ複合体との相互作用が促進されます。この一連のシグナル伝達により、YAP1 がユビキチン化され、プロテアソーム依存的な分解が起こります7。Hippo 経路が不活性化されると、YAP1 は核へ移行し、主に転写因子 TEAD と結合します4。重要なことに、TEAD 以外にも数種類の転写因子が、YAP1 と結合することが示されています(例: SMADs、ß-catenin、Fos、E2F など)4,8,9(図1)。
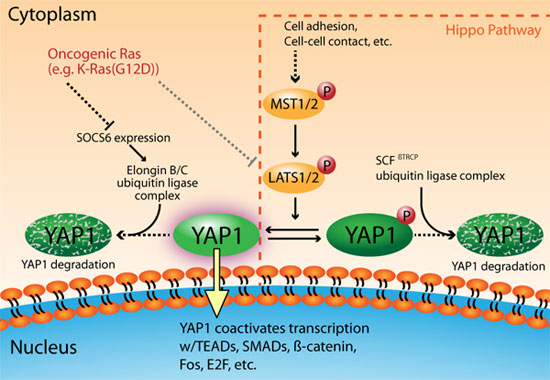
図1 YAP1 の活性化は、発癌に関わる RAS シグナル伝達経路の重要な構成要素である
癌における YAP1 の役割は複雑である
非形質転換細胞に YAP1 を過剰発現させると核に蓄積し、接着非依存性細胞増殖、上皮間葉転換(EMT: epithelial-to-mesenchymal transition)、アポトーシスの抑制、成長因子非依存性増殖などの、腫瘍細胞の全ての特徴を示します2,10。YAP1 と癌の発生との直接的な因果関係は、まだはっきりと証明されていませんが、ほとんどの場合、YAP1 活性の上昇により明らかな腫瘍性の挙動を示します。in vitro において YAP1 の過剰発現を行った報告と一致して、数種類の癌で YAP1 の発現が増加することが示されています2,11。また、YAP1 の活性上昇は、数種類の癌で予後不良に相関することが報告されています12,13。YAP1 の活性化が癌の発生に関与するメカニズムは様々ですが、多くの場合、Hippo 経路の調節不全や、YAP1 遺伝子を含む 11q22 遺伝子座の増幅が原因となります10,14,15。YAP1 は、癌の進行に関与する一方で、腫瘍抑制因子として作用する場合もあります(例: 乳癌や数種類の大腸癌)16,17。この矛盾を解く手がかりの一つが、発癌に関わるシグナル伝達経路において、キナーゼによる YAP1 の2つのチロシン残基(Y357 と Y391)のリン酸化を検討した報告に示されています。チロシンキナーゼ YES1 は、YAP1 の Y357 をリン酸化することでβ-カテニンとの相互作用を促進し、既知の発癌シグナル伝達経路である Wnt シグナル伝達経路を活性化します18, 19。反対に、チロシンキナーゼ c-Abl は、DNA損傷に応答して YAP1 の Y391 をリン酸化することで p73 との結合を促進し、p300 をリクルートしてアポトーシス誘導遺伝子の転写を刺激します(つまり、明らかに腫瘍抑制活性を示します)20。どちらの場合も、YAP1 は核で活性化されますが、YAP1 と結合するパートナーがそれぞれ異なることから、シグナル依存的な相互作用によって、正反対の転写プログラムが決定されます。
YAP は癌細胞の Ras 依存性を抑える
近年の報告により、Ras 依存性の癌において YAP1 の重要性が注目されています8,9,21,22。Ras(H-、K-、N-Ras)の機能獲得型変異は、ヒト癌の 33% で認められます23,24。これらの変異型 Ras アイソフォームは、発癌を促進する主要な因子であり、発生した癌は、変異型 Ras シグナルに非常に強く依存して生存しています25,26。YAP1 は、発癌に関わる Ras シグナル伝達において重要な因子として同定されており、細胞の強い Ras 依存性を抑えることが報告されています8,9,22。Ras シグナル伝達は、LATS キナーゼの不活性化や27、ユビキチンリガーゼ複合体(Hippo経路で用いられる SCFßTRCP 複合体とは異なる)による YAP1 ターンオーバーの調節を介して22、様々なレベルで YAP1 活性を調節します(図1)。後者の場合、 Ras シグナル伝達により、Elongin B/C ユビキチンリガーゼ複合体の YAP1 基質認識部位である SOCS6 の発現が減少します22。その結果、YAP1の発現量が増加して核に蓄積し、結合パートナーである Fos および TEAD2/E2F を介した転写が活性化され、発癌が促進されます8,9,22(図1)。
まとめ
YAP1 が癌細胞の Ras 依存性を制御し、数種類の癌で活性が上昇するという報告から、Ras のみをターゲットとする治療では、YAP1 を介した部分的な抵抗性が示されることが示唆されます。また、YAP1 は細胞の状況により、 発癌促進または抑制のどちらかに作用することから、発癌性 Ras をターゲットとする治療薬の開発において、YAP1 の抗腫瘍活性を利用できる可能性があります。YAP1 活性は、数種類の翻訳後修飾(PTM)により調節されることが報告されています(例: セリンとチロシンのリン酸化、およびユビキチン化)。Cytoskeleton(サイトスケルトン)社では、Ras 活性アッセイ、 PTM 抗体、GEF アッセイなど、本分野の研究にご使用いただける製品をご提供しております。
参考文献
- B. Zhao et al. 2015. The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nat. Cell Biol. 13, 877-883.
- J. Dong et al. 2007. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 130, 1120-1133.B.
- Zhao et al. 2007. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth control. Genes Dev. 21, 2747-2761.
- K. Wang et al. 2009. YAP, TAZ, and Yorkie: a conserved family of signal-responsive transcriptional coregulators in animal development and human disease. Biochem. Cell Biol. 87, 77-91.
- B.C. Low et al. 2014. YAP/TAZ as mechanosensors and mechanotransducers in regulating organ size and tumor growth. FEBS Lett. 588, 2663-2670.
- K.D. Irvine. 2012. Integration of intercellular signaling through the Hippo pathway. Semin. Cell Dev. Biol. 23, 812-817.
- B. Zhao et al. 2010. A coordinated phosphorylation by Lats and CK1 regulates YAP stability through SCFb-TRCP. Genes Dev. 24, 72-85.
- D.D. Shao et al. 2014. KRAS and YAP1 converge to regulate EMT and tumor survival. Cell. 158, 171-184.
- A. Kapoor et al. 2014. Yap1 activation enables bypass of oncogenic Kras addiction in pancreatic cancer. Cell. 158, 185-197.
- M. Overholtzer et al. 2006. Transforming properties of YAP, a candidate oncogene on the chromosome 11q22 amplicon. Proc. Natl. Acad. Sci. U.S.A. 103, 12405-12410.
- D.M. Lam-Himlin et al. 2006. The hippo pathway in human upper gastrointestinal dysplasia and carcinoma: a novel oncogenic pathway. Int. J. Gastrointest. Cancer. 37, 103-109.
- M.Z. Xu et al. 2009. Yes-associated protein is an independent prognostic marker in hepatocellular carcinoma. Cancer. 115, 4576-4585.
- C.A. Hall et al. 2010. Hippo pathway effector Yap is an ovarian oncogene. Cancer Res. 70, 8517-58525.
- L. Zender et al. 2006. Identification and validation of oncogenes in liver cancer using an integrative oncogenomic approach. Cell. 125, 1253-1267.
- T. Muramatsu et al. 2011. YAP is a candidate oncogene for esophageal squamous cell carcinoma. Carcinogenesis. 32, 389-398.
- M. Yuan et al. 2008. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death Differ. 15, 1752-1759.
- E.R. Barry et al. 2013. Restriction of intestinal stem cell expansion and the regeneration response by YAP. Nature. 493, 106-110.
- J. Rosenbluh et al. 2012. b-Catenin-driven cancers require a YAP1 transcriptional complex for survival and tumorigenesis. Cell. 151, 1457-1473.
- J. Rosenbluh et al. 2014. Genomic insights into WNT/b-catenin signaling. Trends Pharmacol. Sci. 35, 103-109.
- D. Levy et al. 2008. Yap1 phosphorylation by c-Abl is a critical step in selective activation of proapoptotic genes in response to DNA damage. Mol. Cell. 29, 350-361.
- W. Zhang et al. 2014. Downstream of mutant KRAS, the transcriptional regulator YAP is essential for neoplastic progression to pancreatic ductal adenocarcinoma. Sci. Signal. 7, ra42.
- X. Hong et al. 2014. Opposing activities of the Ras and Hippo pathways converge on regulation of YAP protein turnover. EMBO J. 33, 2447-2457.
- A.T. Baines et al. 2011. Inhibition of Ras for cancer treatment: the search continues. Future Med Chem. 3, 1787-1808.
- A.E. Karnoub and R.A. Weinberg. 2008. Ras oncogenes: split personalities. Nat. Rev. Mol. Cell Biol. 9, 517-531.
- I.B. Weinstein. 2002. Cancer. Addiction to oncogenes – the Achilles heal of cancer. Science. 297, 63-64.
- F. McCormick. 2011. Cancer therapy based on oncogene addiction. J. Surg. Oncol. 103, 464-467.
- B.V. Reddy and K.D. Irvine. 2013. Regulation of Hippo signaling by EGFR-MAPK signaling through Ajuba family proteins. Dev. Cell. 24, 459-471.
アセチルリジン マウスモノクローナル抗体
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥34,000 |
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥125,000 |
ホスホチロシン(リン酸化チロシン) マウスモノクローナル抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Phosphotyrosine (Trial Size), (Mouse) , 27B10.4 |
CYT | APY03-S | 1*25 UL |
¥16,000 |
Anti Phosphotyrosine, (Mouse) , 27B10.4 |
CYT | APY03 | 2*100 UL |
CYT社 APY03 3*100 を参照 |
ユビキチン マウスモノクローナル抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥34,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
¥125,000 |
Ras G-LISA® 活性型低分子量Gタンパク質定量キット
- G-LISA® 活性型低分子量Gタンパク質定量キット
- 少量のサンプルから、3時間以内で活性型低分子量Gタンパク質を測定するキット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
Ras プルダウンアッセイ Biochem Kit™
- 活性型低分子量Gタンパク質 プルダウンアッセイ Biochem Kit™
- 低分子量Gタンパク質活性化を、プルダウンアッセイで簡単に検出!
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
RhoGEF Exchange アッセイ Biochem Kit™
- RhoGEF exchange アッセイキット
- GTPase(GTPアーゼ)のヌクレオチド交換を蛍光により測定
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoGEF Exchange Assay |
CYT | BK100 | 1 KIT [60-300 assays] |
¥227,000 |
SOS exchange ドメイン (564-1049) タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SOS1 Ras GEF protein, Human |
CYT | CS-GE02 | 100 UG [1 x 100 μg] |
販売終了 |
SOS1 Ras GEF protein, Human |
CYT | CS-SOS1-B | 1 MG [1 x 1 mg] |
販売終了 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













