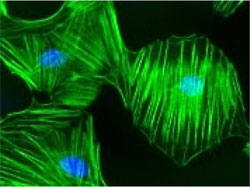
コフィリンは、細胞運動に必須となるアクチンの再構築において重要な役割を果たしている、アクチン結合/切断タンパク質です。近年、H.-H. Zhang らによって、S-ニトロシル化(SNO)がコフィリンの活性に与える影響について研究が行われました。SNO は、標的タンパク質上の特定のシステイン残基に一酸化窒素(NO)が共有結合する、翻訳後修飾(PTM)です。NO は、PTM を引き起こすだけでなく、血管形成および血管新生において不可欠なステップである、血管内皮増殖因子(VEGF)によって誘導される内皮細胞の移動を仲介します。これらの生理的なプロセスには、内皮細胞のアクチンの再構築が含まれています。筆者らは、培養内皮細胞において、NO が介する VEGF の活性化が野生型コフィリンの SNO を刺激することを見出しました。蛍光顕微鏡を使用して、蛍光およびビオチン標識アクチンフィラメントの長さと数を測定したところ、野生型および SNO 模倣型変異体コフィリンは、どちらも in vitro で F-アクチン切断活性を示しました。 変異型コフィリンは、野生型コフィリンより F-アクチン切断活性が高いことから、SNO 模倣型コフィリンはより高い F-アクチン結合能を持つ可能性があります。さらに、筆者らは、トランスフェクトされていない内皮細胞において、 VEGF が F-アクチン形成を増加させること、また、野生型コフィリンの過剰発現によりこの効果が阻害されることを示しました。
Cytoskeleton(サイトスケルトン/CYT)社の G/F-アクチン in vivo アッセイキット(品番: BK037)、ローダミン標識筋アクチン(品番: AR05)、ビオチン標識筋アクチン(品番: AB07)、精製筋アクチン(品番: AKL99)は、コフィリンが介するアクチンの再構築や、内皮細胞の移動に関与するメカニズムなどの研究にご使用いただけます。























 このページを印刷する
このページを印刷する














