記事ID : 36703
タウ(Tau)の将来性をMapping CYTOSKELETON NEWS 2020年2月号

タウ(Tau)の将来性をMapping
タウ(Tau)は、構造的微小管関連タンパク質(MAP)であり、主に(排他的ではなく)神経軸索内の微小管(Microtubules)に局在しています。タウは、主に神経変性タウオパチー(アルツハイマー病、皮質基底核変性、前頭側頭型認知症など)における中心的な役割により、おそらく最も研究されているMAPです1,2)。タウは、最初に微小管の会合を促進するMAPとして報告され3-5)、現在では微小管安定化、微小管の束の形成、微小管依存性軸索輸送の調節、および神経突起伸長の制御などもその役割として知られています1, 2, 6-10)。しかし、どのようにしてタウが微小管機能構築を制御しているのか、生理学的に完全に理解するには至っていません。タウが微小管や他のMAPsと相互作用する手段についての最新の4報告を以下で討論します。
特に顕微鏡の技術的進歩により、どのようにタウが微小管に結合するのか、これまで例をみないほど直接的かつ単一分子での洞察が得られるようになりました9-11)。近年の、クライオ電子顕微鏡法より、タウの繰り返し微小管結合領域には拡張構造が取り入れられており、チューブリンヘテロ二量体間の相互作用を安定化するため原繊維に沿って微小管表面に結合することが示唆されました12)(図1)。それぞれの繰り返し領域にある拡張構造は二量体内および二量体間境界面にまたがっており、チューブリンヘテロ二量体間の接続ができるようになっています12)(図1)。原子レベルに近いこれらの分析により、おそらくタウの急速なオン-オフ率を安定化するものが存在せず13)、タウは微小管会合を促進するのに理想的であると提唱する研究者もいます10)。タウの速度は迅速な単一分子追跡実験により決定されました。神経由来の生細胞および初代神経細胞において、40ミリ秒間隔で迅速にオン-オフしながらタウは動的に結合、解離し、素早く近接した微小管に結合(“kiss and hop”とよばれる)します13)。微小管滞留時間(以前に報告されたものより2桁も短い14))が意外に短時間であるにもかかわらず、タウは神経突起におけるチューブリン重合化の有力なプロモーターです。これらの知見は、構造的MAPsは解体を防ぐため静的な方法で微小管表面に接着するという定説を覆すものです。
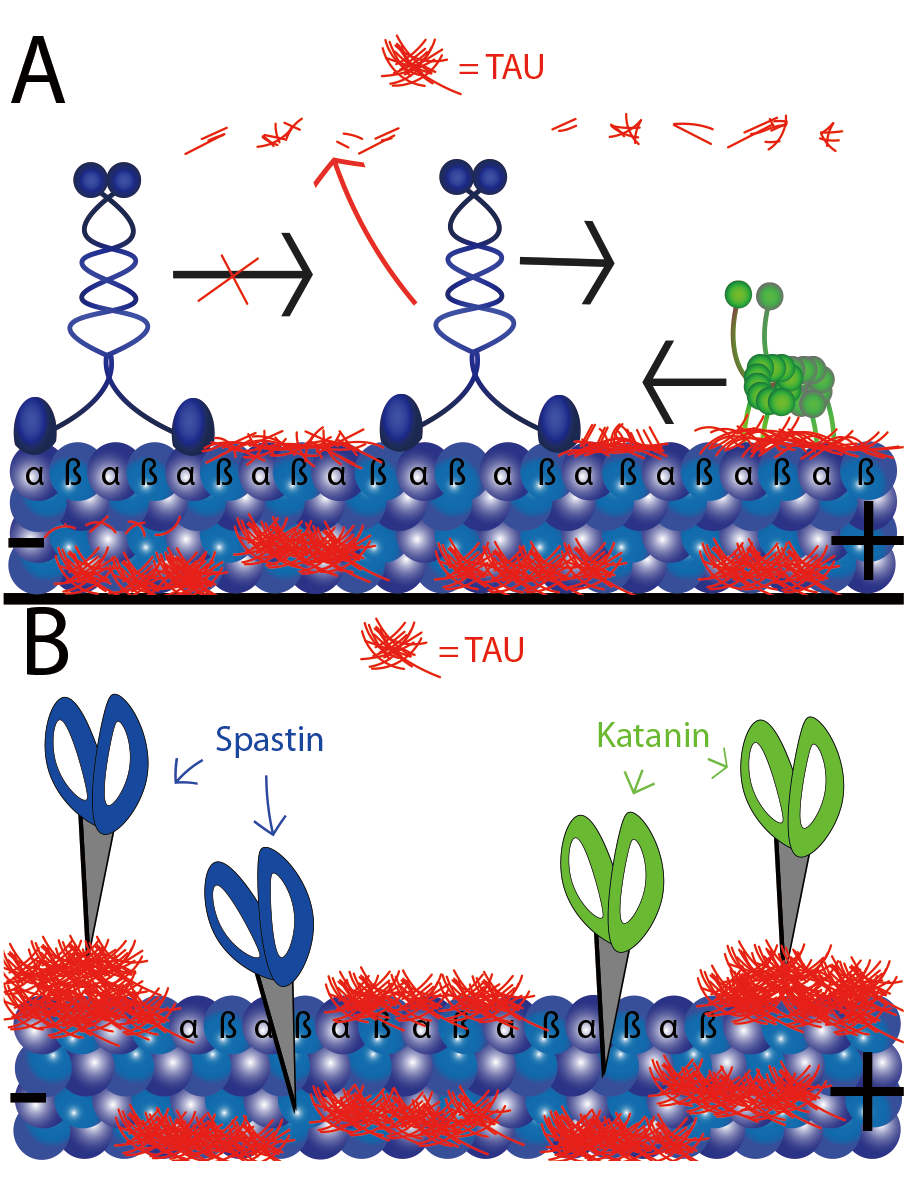
図1. タウとその構造的MAPとしての複数の役割
タウは集団(凝縮物またはアイランド)として微小管やチューブリン多量体に結合し、運動性または非運動性MAPsの結合や活性を制御する。タウは二量体を接続するチューブリンヘテロ二量体と相互作用することで二量体界面間に結合します。
A:タウ凝縮物はキネシン-1とキネシン-3のプラス末端指向の運動性を遮断するものの、キネシン-8は遮断しない。キネシン-8は凝縮物の解体を引き起こす。ダイニンのマイナス末端指向の運動性は主に妨げられない。
B:タウ凝縮物は微小管切断酵素スパスチンやカタニンをブロックします。
緑色運動:ダイニン、青色運動:キネシン
タウは長年研究されてきた構造的MAPではあるものの、他のMAPsのタウ介在性制御に関して引き続き新規の知見が出てきています。近年の研究では、微小管に局在化するタウにおいて新たな空間的かつ機能的な不均一性が報告されています15-17)。結合したタウの高密度アイランド(凝縮物ともいう)が生理的かつ可逆的に集まり、微小管を区画化するため個々の微小管が分散した領域に沿って分布し、選択的にMAP透過性の障壁を形成します15-17)(図1)。初期の報告では微小管上のタウ“パッチ”に関する記述があります18)が、Siahaanら16)は、タウアイランドはこれらのパッチとは“基本的に異なる”と仮定しました。微小管湾曲の高い領域に形成されるこの凝縮物はヌクレオチド状態の微小管格子により制御され、チューブリンのC-末端尾部に依存しています17)。タウはオン-オフ速度が速いのにもかかわらず、結合や運動性の機能(例えば、プラス末端指向のキネシンモーターやマイナス末端指向のダイニンモーター)や18-22)、非運動性MAPs(例えば、スパスチンやカタリンといった微小管切断酵素やMAP6、MAP7)16, 17)を制御します(図1)。タウ凝縮物はキネシン運動性をアイソタイプ特異的な様式で阻害します。近年の一分子イメージン研究により、タウ凝縮物が様々なMAPsとどのように相互作用するのか、さらなる洞察を得ることができます15-17)。凝縮物/アイランドはキネシン-1とキネシン-3の運動性を停止させますが、キネシン-8はタウ凝縮物を通過し、分解を引き起こします15-17)。同様に、ダイニンモーターの大部分は、一時停止後に凝縮液/アイランドを通過します16)。短縮されてはいるものの活性型の微小管切断酵素であるスパスチンとカタニンはほとんどが凝縮物より排除されているため、微小管が切断されるのを防いでいます15-17)。タウ発現はMAP7やMAP6の発現と機能に反比例します。タウ発現はMAP7やMAP6の発現と機能に逆比例します。MAP7はタウと同一の微小管結合部位をめぐって競合し、タウ凝縮物/アイランドを置換することができます15)。また、in vivoとin vitroにおいて、MAP7はキネシンベースのカーゴ輸送とキネシン-1の微小管への結合をそれぞれ正に制御します15)。結合タウのMAP7介在性破壊が生じたのち、MAP7はキネシン-1を動員して元々タウに占拠されていた微小管部位に結合させます15)。2つのMAPsはいつも拮抗性であるわけではなく、例えばMAP7とタウはいずれもキネシン-3の運動性を阻害します15)。MAP6とタウの関係については以下で議論しましょう。特筆すべきこととして、Yuanら23)は、in vivoにおいて網膜神経節細胞軸索におけるタウ発現レベルの変化(上昇または低減)は、軸索輸送速度に影響しないことを見つけました。タウによる軸索輸送制御に関するこれらの一見共通点のないデータについては、タウ / 微小管相互関係に対する“kiss and hop”機構モデルがこのin vivo結果と適合性をもつとはいえ、さらなる分析が必要でしょう13)。
ほぼ間違いなく、最も示唆に富むタウの結果がまさに何十年もタウ研究を先導してきた定説に異議を申し立てているのです。生理学的および病理学的の何れのタウ研究でも、そのほとんどが生理条件下においてタウは微小管の安定剤である、また、病理学的過剰リン酸化を受けてタウが微小管から解離することでその安定性が損なわれ解体が生ずる、という仮定のもとに始まっています1, 2, 10)。正常な軸索微小管は不安定なドメインと安定なドメインから構成24-26)されており、タウは主に前者の領域に結合しています10, 27)。これに対し、MAP6は軸索微小管の安定化ドメインに優先的に結合します28, 29)。培養ラット神経細胞においてタウを喪失させると、不安定な微小管ドメインが失われ、安定化ドメインが増大します。さらに、MAP6の発現が増大し、その軸索微小管上における分布が拡大します10, 27)。一方で、MAP6欠損では不安定微小管ドメインにおける不安定化が進み、結果としてタウ発現レベルの上昇とその軸索微小管に沿った分布が増大します10, 27)。これらの知見は、実はタウは微小管の安定剤ではなく、長鎖不安定ドメインの会合を促進しMAP6介在性安定化を妨害して微小管に柔軟性を与えるといった結果の基盤となっています10, 27)。
まとめタウは数十年前に発見されタウオパシーにおいて中心的な役割を担うものの、正常または疾患神経細胞においてタウがどのようにして微小管構造、機能、および他のMAPsへの結合を制御するのか未だによくわかっていません。この知識不足はタウだけでなく他のMAPsにも言えることでしょう。研究者の方々による微小管およびMAPの機能や相互作用に関する研究をご支援するため、Cytoskeleton社では、チューブリン重合化や結合アッセイキット、微小管生細胞イメージングプローブ、および、様々な翻訳後修飾を検出し測定できるSignal-Seeker Enrichment kitsなどをご用意しています。
参考文献
- Iqbal K. et al. 2016. Tau and neurodegenerative disease: the story so far. Nat. Rev. Neurol. 12, 15-27.
- Gao Y.-L. et al. 2018. Tau in neurodegenerative disease. Ann. Transl. Med. 6, 175.
- Weingarten M.D. et al. 1975. A protein factor essential for microtubule assembly. Proc. Natl. Acad. Sci. USA. 72, 1858-1862.
- Cleveland D.W. et al. 1977a. Purification of tau, a microtubule-associated protein that induces assembly of microtubules from purified tubulin. J. Mol. Biol. 116, 207-225.
- Cleveland D.W. et al. 1977b. Physical and chemical properties of purified tau factor and the role of tau in microtubule assembly. J. Mol. Biol. 116, 227-247.
- Kanai Y. et al. 1989. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. J. Cell Biol. 109, 1173-1184.
- Scott C.W. et al. 1992. Tau protein induces bundling of microtubules in vitro: comparison of different tau isoforms and a tau protein fragment. J. Neurosci. Res. 33, 19-29.
- Barlow S. et al. 1994. Stable expression of heterologous microtubule-associated proteins (MAPs) in Chinese hamster ovary cells: evidence for differing roles of MAPs in microtubule organization. J. Cell Biol. 126, 1017-1029.
- Bodakuntla S. et al. 2019. Microtubule-associated proteins: Structuring the cytoskeleton. Trends Cell Biol. 29, 804-819.
- Baas P.W. and Qiang L. 2019. Tau: It’s not what you think. Trends. Cell Biol. 29, 452-461.
- Nogales E. 2016. The development of cryo-EM into a mainstream structural biology technique. Nat. Methods. 13, 24-27.
- Kellogg E.H. et al. 2018. Near-atomic model of microtubule-tau interactions. Science. 360, 1242-1246.
- Janning D. et al. 2014. Single-molecule tracking of tau reveals fast kiss-and-hop interaction with microtubules in living neurons. Mol. Biol. Cell. 25, 3541-3551.
- Konzack S. et al. 2007. Swimming against the tide: mobility of the microtubule-associated protein tau in neurons. J. Neurosci. 27, 9916-9927.
- Monroy B.Y. et al. 2018. Competition between microtubule-associated proteins directs motor transport. Nat. Commun. 9, 1487.
- Siahaan V. et al. 2019. Kinetically distinct phases of tau on microtubules regulate kinesin motors and severing enzymes. Nat. Cell Biol. 21, 1086-1092.
- Tan R. et al. 2019. Microtubules gate tau condensation to spatially regulate microtubule functions. Nat. Cell Biol. 21, 1078-1085.
- Dixit R. et al. 2008. Differential regulation of dynein and kinesin motor proteins by tau. Science. 319, 1086-1089.
- Ebneth A. et al. 1998. Overexpression of tau protein inhibits kinesin-dependent trafficking of vesicles, mitochondria, and endoplasmic reticulum: implications for Alzheimer’s disease. J. Cell Biol. 143, 777-794.
- Trinczek B. et al. 1999. Tau regulates the attachment/detachment but not the speed of motors in microtubule-dependent transport of single vesicles and organelles. J. Cell Sci. 112, 2355-2367.
- Seitz A. et al. 2002. Single-molecule investigation of the interference between kinesin, tau and MAP2c. EMBO J. 21, 4896-4905.
- Vershinin M. et al. 2007. Multiple motor based transport and its regulation by Tau. Proc. Natl. Acad. Sci. USA. 104, 87-92.
- Yuan A. et al. 2008. Axonal transport rates in vivo are unaffected by tau deletion or overexpression in mice. J. Neurosci. 28, 1682-1687.
- . Baas P.W. and Black M.M. 1990. Individual microtubules in the axon consist of domains that differ in both composition and stability. J. Cell Biol. 111, 495-509.
- Baas P.W. et al. 1991. Microtubule dynamics in axons and dendrites. J. Neurosci. Res. 30, 134-153.
- Brown A. et al. 1993. Composite microtubules of the axon: quantitative analysis of tyrosinated and acetylated tubulin along individual axonal microtubules. J. Cell Sci. 104, 339-352.
- Qiang L. et al. 2018. Tau does not stabilize axonal microtubules but rather enables them to have long labile domains. Curr. Biol. 28, 2181-2189.
- Slaughter T. and Black M.M. 2003. STOP (stable-tubule-only-polypeptide) is preferentially associated with the stable domain of axonal microtubules. J. Neurocytol. 32, 399-413.
- Tortosa E. et al. 2017. Dynamic palmitoylation targets MAP6 to the axon to promote microtubule stabilization during neuronal polarization. Neuron. 94, 809-825.
Tubulin Live Cell Imaging Products
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥182,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
SiR700-Tubulin Kit |
CYT | CY-SC014 | 1 KIT [35-200 slides] |
¥182,000 |
Tubulin Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin Polymerization Assay Kit, Porcine |
CYT | BK004P | 1 KIT [24 assays] |
¥221,000 |
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥300,000 |
Tubulin Polymerization Assay |
CYT | BK011P | 1 KIT [96 assays] |
¥317,000 |
Microtubule Binding Protein Spin Down Assay Kit |
CYT | BK029 | 1 KIT [30-100 assays] |
¥265,000 |
Signal Seeker™ Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
CYT社 BK160L 1 を参照 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
CYT社 BK161L 1 を参照 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
CYT社 BK162L 1 を参照 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
CYT社 BK163L 1 を参照 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM SUMOylation-1 Detection Kit |
CYT | BK165 | 1 KIT [30 assays] |
CYT社 BK165L 1 を参照 |
Signal-SeekerTM SUMOylation-1 Detection Kit |
CYT | BK165-S | 1 KIT [10 assays] |
¥128,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する














