記事ID : 36111
細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格 CYTOSKELETON NEWS 2019年9月号

細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
細胞膜張力は、エキソサイトーシス、エンドサイトーシス、分裂、および運動性をはじめとする数々の細胞機能を制御します1-6) が、これら全てにおいて細胞形態の再形成を必要とし、細胞膜変形とアクチン細胞骨格のリモデリングとの相互作用に依存します1, 3, 5-9)。本ニュースレターでは、運動性関連の形態形成におけるアクチン細胞骨格と膜張力との協調的相互作用についてお伝えします。
指向性の細胞運動には細胞の前部と後部(それぞれ、最先端と後縁)においてアクチン細胞骨格の動的な再編成が必要であり、アクチン基盤の葉状仮足突起が伸展し細胞を前方に引きながら、これと平衡して接着部位の変化とRhoA介在性アクトミオシン収縮性を介した後縁における退縮が生じます8, 10, 11)。アクチン基盤の突出により運動性細胞の最先端が前方に押し出され、後縁では収縮が生じ、細胞膜が変形し、膜張力が変化します。指向性の運動はアクチン細胞骨格再編成と変形による膜張力変化のバランスに依存します8)(図1)。
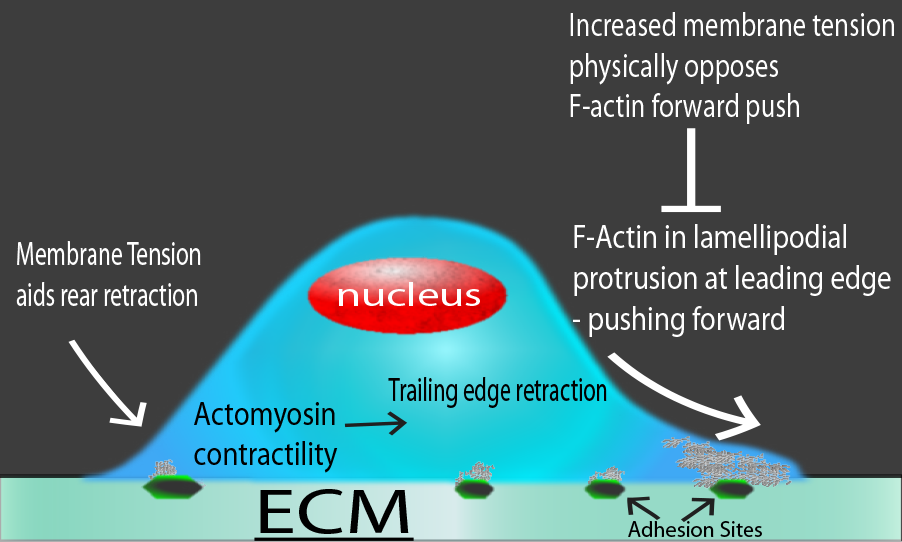
図1.移動細胞における様々な力の概略図
細胞最先端におけるアクチン基盤の突出(例えば、葉状仮足)により細胞が前方に押し出され、膜張力が物理的にこの運動性に対抗します。後縁では、膜張力がアクトミオシン介在性退縮を助けます。
膜張力とアクチン細胞骨格の双方の動的再編成がどのように相互作用することで細胞の形態形成や運動性を可能とするのか、魚の角膜実質細胞または生きた無傷の角膜実質細胞の葉状仮足断片を用いた初期の2D細胞運動性実験よりひとつのモデルが提案されています8, 12)。
このモデルでは、運動性細胞の最先端内における重合化アクチンネットワークにより細胞膜が内部より押され、アクチンによる突出に物理的に対抗する膜張力が産生し、迅速に平衡化され、重合化アクチンネットワーク上に線維長単位あたり一定した力を包括的に発揮する12)と仮定しています。(図1)。細胞最先端の中央では、アクチン線維密度が高いため線維当たりの膜張力が低くなり、アクチン線維が迅速に重合化することができ最先端における突出が駆動されます。細胞の側面に向かい線維密度が低下するのに従い、膜張力誘導性負荷がアクチン重合化を失速させるまで線維当たりの抵抗が増大し、これにより細胞の前方角が構築されます12)。同様に、線維芽細胞における初期の研究より、膜張力と葉状仮足突出数が逆相関することがわかっています1)。これに伴い、移動細胞の後縁ではアクチンネットワークが分解しており、その脱重合が膜張力の増大により促進され、後縁退縮が生じます12-14)(図1)。運動性角膜実質細胞の生細胞画像処理研究より、運動性細胞において面内張力(膜内の張力自身)と膜-細胞骨格付着(接着とアクトミオシン介在性収縮性)の何れもが膜張力を制御することが報告されています15)。実際、全膜張力は両方の因子により決定します8)。Lieberらは15)、アクチン重合化が最先端で増大すると、線維のより強力な前方推進力によりより高い膜張力が誘起され、またその逆も真であることを確認しました。後縁では、膜張力はミオシン収縮レベルと逆相関し、接着力と正に相関します15)。
線維芽細胞や線維芽細胞様細胞における近年の研究より、アクチン細胞骨格と膜張力間の相互作用がさらに明らかとなりました。線維芽細胞における高解像度顕微鏡研究より16)、膜蓄積が十分である場合、葉状仮足突出の初期段階では突出長が優位であり膜張力が低いことが明らかとなりました。葉状仮足は膜上で外向きに押し、膜張力が増大して(膜内張力)、伸展する突出が細胞膜内のいかなる折り畳みや曲線をも伸ばします。膜蓄積が消耗するにつれ張力は急速に増大し、これに伴いアクチン細胞骨格が再編成され、突出長の低減が生じます16)。好中球では、移動細胞の最先端における突出増大と同時に最先端以外にもいくつかの細胞部位において膜張力の増大や突出数の低減が発生します7)。その他の線維芽細胞研究17) より、膜張力における周期的変動は葉状仮足突出形態に逆相関することが報告されています。張力が増大すると突出サイズと形が低減(幅が減少し上方に曲がる)し、張力が消散すると突出のサイズ、形、および成長活性は元に戻ります17)。アクチン関連タンパク質であるFBP17(formin-binding protein17) は、膜結合タンパク質であり、運動性COS-1(線維芽細胞様)細胞の最先端におけるWASP/N-WASP依存性アクチン核形成の活性化因子です。膜張力はその膜脱離を惹起することでFBP17機能を阻害し、張力がアクチン重合化を阻害するシグナル伝達経路を提示します18, 19)。このことから、プロアクチン会合分子の不活化により膜張力の増大がさらなる突出発生を最終的に阻害するといった負のフィードバックループが存在することが示唆されます8, 18, 19)。その他のアクチン結合タンパク質やキャッピングタンパク質もまた、細胞最先端突出を補助するアクチンネットワークの動的な組織修復を制御します20)。ホスホリパーゼD2や好中球のラパマイシン複合体2機械感覚性シグナル伝達カスケードの哺乳動物標的もまた、張力がアクチン核形成を阻害する手段を与えます。
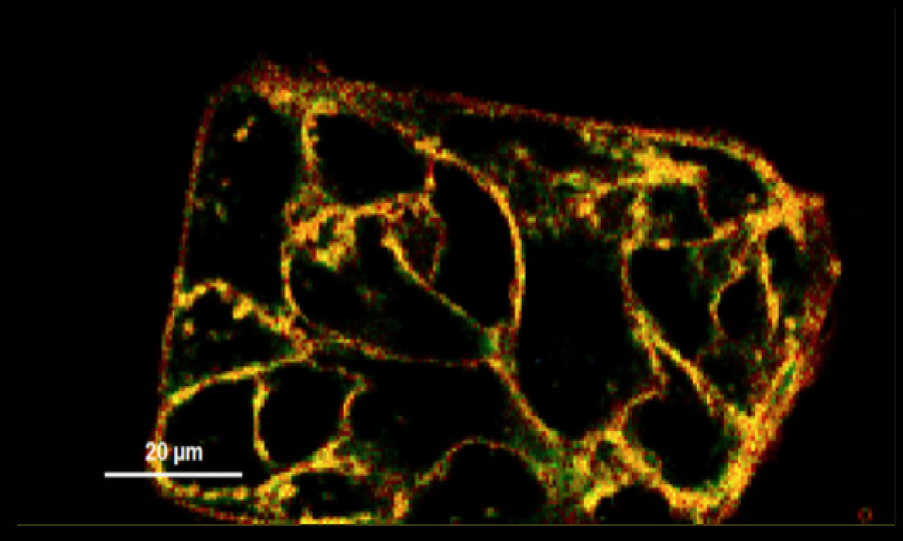
図2.FLIPPER-TR membrane tension probe (Cat # CY-SC020)で染色した細胞膜の光寿命顕微結果
緑色は中程度の張力を示し、黄/橙/赤色は高張力下、青色はより低い張力であることを示す。画像はColom et al. 2018. のものよりご提供頂いた。
まとめ
膜張力の機能的関連性は、膜張力(および秩序や電位といった他の膜性状)がほとんど全ての致命的な生物学的プロセスに影響を及ぼすことから生物物理学的領域以上のものがあります。生細胞における張力や動的変化の測定が極めて困難であることもわかっています。課題として、2D細胞培養で得られた結果を3D細胞培養において検証すること、張力測定の際に膜張力の制御が細胞型間だけでなく細胞の状態によって如何に変動するか精査すること、などが挙げられます8)。生細胞における膜張力における変化をリアルタイムで特異的に研究できるようデザインされた蛍光機械感受性プローブが開発され市販製品が入手可能であることは非常に素晴らしいことです9, 22, 23)。Cytoskeleton社では、細胞生物学者が基礎的な細胞機能を制御するために膜張力がどのようにして細胞骨格と相互作用するかより深く探究する上で役立つ新規蛍光プローブであるFlipper-TR™をご提供しています(図2)。さらに、Cytoskeleton社では、F-アクチン、微小管、およびDNA用の生細胞画像処理プローブや、G-アクチンやF-アクチンの細胞内レベルやin vitroにおける相互作用を研究するためのBiochem Kitsをご提供しています。参考文献
- Raucher D. and Sheetz M.P. 2000. Cell spreading and lamellipodial extension rate is regulated by membrane tension. J. Cell Biol. 148, 127-136.
- Keren K. 2011. Cell motility: the integrating role of the plasma membrane. Eur. Biophys. J. 40, 1013-1027.
- Diz-Munoz A. et al. 2013. Use the force: Membrane tension as an organizer of cell shape and motility. Trends Cell Biol. 23, 47-53.
- Masters T.A. et al. 2013. Plasma membrane tension orchestrates membrane trafficking, cytoskeletal remodeling, and biochemical signaling during phagocytosis. Proc. Natl. Acad. Sci. U.S.A. 110, 11875-11880.
- Clark A.G. et al. 2014. Stresses at the cell surface during animal cell morphogenesis. Curr. Biol. 24, R484-R494.
- Sens P. and Plastino J. 2015. Membrane tension and cytoskeleton organization in cell motility. J. Phys. Condens. Matter. 27, 273103.
- Houk A.R. et al. 2012. Membrane tension maintains cell polarity by confining signals to the leading edge during neutrophil migration. Cell. 148, 175-188.
- Pontes B. et al. 2017. Membrane tension: A challenging but universal physical parameter in cell biology. Semin. Cell Dev. Biol. 71, 30-41.
- Colom A. et al. 2018. A fluorescent membrane tension probe. Nat. Chem. 10, 1118-1125.
- Warner H. et al. 2019. Control of adhesion and protrusion in cell migration by Rho GTPases. Curr. Opin. Cell Biol. 56, 64-70.
- Lawson C.D. and Ridley A.J. 2018. Rho GTPase signaling complexes in cell migration and invasion. J. Cell Biol. 217, 447-457.
- Keren K. et al. 2008. Mechanism of shape determination in motile cells. Nature. 453, 475-480.
- Kozlov M.M. and Mogilner A. 2007. Model of polarization and bistability of cell fragments. Biophys. J. 93, 3811-3819.
- Ofer N. et al. 2011. Actin disassembly clock determines shape and speed of lamellipodial fragments. Proc. Natl. Acad. Sci. U.S.A. 108, 20394-20399.
- Lieber A.D. et al. 2013. Membrane tension in rapidly moving cells is determined by cytoskeletal forces. Curr. Biol. 23, 1409-1417.
- Gauthier N.C. et al. 2011. Temporary increase in plasma membrane tension coordinates the activation of exocytosis and contraction during cell spreading. Proc. Natl. Acad. Sci. U.S.A. 108, 14467-14472.
- Pontes B. et al. 2017. Membrane tension controls adhesion positioning at the leading edge of cells. J. Cell Biol. 216, 2959-2977.
- Zegers M.M. and Friedl P. 2015. membrane tension into cytoskeletal action by FBP17. Dev. Cell. 33, 628-630.
- Tsujita K. et al. 2015. Feedback regulation between plasma membrane tension and membrane-bending proteins organizes cell polarity during leading edge formation. Nat. Cell Biol. 17, 749-758.
- Simon C. et al. 2018. Interplay between membrane tension and the actin cytoskeleton determines shape changes. Phys. Biol. 15, 065004.
- Diz-Munoz A. et al. 2016. Membrane tension acts through PLD2 and mTORC2 to limit actin network assembly during neutrophil migration. PLoS Biol. 14, e1002474.
- Molin M.D. et al. 2015. Fluorescent flippers for mechanosensitive membrane probes. J. Am. Chem. Soc. 137, 568-571.
- Goujon A. et al. 2019. Mechanosensitive fluorescent probes to image membrane tension in mitochondria, endoplasmic reticulum, and lysosomes. J. Am. Chem. Soc. 141, 3380-3384.
Live Cell Imaging Products
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥180,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
SiR-DNA Kit |
CYT | CY-SC007 | 1 KIT [50-300 slides] |
¥119,000 |
SiR-Lysosome Kit |
CYT | CY-SC012 | 1 KIT [50-300 slides] |
¥130,000 |
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥180,000 |
SiR700-Tubulin Kit |
CYT | CY-SC014 | 1 KIT [35-200 slides] |
¥180,000 |
SiR700-DNA Kit |
CYT | CY-SC015 | 1 KIT [35-200 slides] |
¥119,000 |
SiR700-Lysosome Kit |
CYT | CY-SC016 | 1 KIT [35-200 slides] |
¥130,000 |
Flipper-TR |
CYT | CY-SC020 | 50 NMOL [35-200 slides] |
¥139,000 |
BioChem Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Binding Protein Spin-down Biochem Kit (for muscle) |
CYT | BK001 | 1 KIT [30-100 assays] |
¥254,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
G-LISA Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoA G-LISA(R) Activation Assay (luminescence) |
CYT | BK121 | 96 ASSAY |
¥302,000 |
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
¥302,000 |
RhoA G-LISA(R) Activation Assay (absorbance), Trial Size |
CYT | BK124-S | 24 ASSAY |
¥189,000 |
Rac1,2,3 G-LISA(R) Activation Assay Kit |
CYT | BK125 | 96 ASSAY |
¥302,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK126 | 1 KIT [96 assays] |
¥302,000 |
Cdc42 G-LISA(R) Activation Assay Kit |
CYT | BK127 | 96 ASSAY |
¥302,000 |
Cdc42 G-LISA(R) Activation Assay Kit, Trial Size |
CYT | BK127-S | 24 ASSAY |
¥189,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
¥302,000 |
Rac1 G-LISA(R) Activation Assay Kit, Trial Size |
CYT | BK128-S | 24 ASSAY |
¥189,000 |
RalA G-LISA(R) Activation Assay Kit |
CYT | BK129 | 1 KIT [96 assays] |
¥302,000 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
Arf1 G-LISA Activation Assay Kit |
CYT | BK132 | 96 ASSAY |
販売終了 |
Arf6 G-LISA Activation Assay Kit |
CYT | BK133 | 96 ASSAY |
販売終了 |
G-LISA Bundle (BK135 = BK124-S + BK127-S + BK128-S) |
CYT | BK135 | 3 KIT [24 assays/kit] |
お問い合わせ |
RhoA ELISA Kit |
CYT | BK150 | 1 KIT [96 assays] |
¥169,000 |
Acti-Stain Phalloidins
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Acti-stainTM 488 phalloidin, Plant |
CYT | PHDG1-A | 1*500 UL [300 slides] |
¥74,000 |
Acti-stainTM 555 phalloidin, Mushroom |
CYT | PHDH1-A | 1*500 UL [300 slides] |
¥74,000 |
Acti-stainTM 670 phalloidin, Plant |
CYT | PHDN1-A | 1*500 UL [300 slides] |
¥74,000 |
Phalloidin; Fluorescent Derivatives (Acti-StainTM 535), Rhodamine Isothiocyanate |
CYT | PHDR1 | 1*500 UL [300 slides] |
¥74,000 |
Pull-Down Activation
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008-S | 1 KIT [20 assays] |
¥124,000 |
Combo RhoA/Rac1/Cdc42 Activation Assay Kit |
CYT | BK030 | 1 KIT [3 x 10 assays] |
¥327,000 |
Arf1 Pulldown Activation Assay Kit |
CYT | BK032-S | 20 ASSAY |
¥160,000 |
Arf6 Pulldown Activation Assay Kit |
CYT | BK033-S | 20 ASSAY |
¥160,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034 | 1 KIT [50 assays] |
¥269,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034-S | 1 KIT [20 assays] |
¥124,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
¥269,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035-S | 1 KIT [20 assays] |
¥124,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036 | 1 KIT [80 assays] |
¥269,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036-S | 1 KIT [20 assays] |
¥124,000 |
RalA Activation Assay Biochem Kit |
CYT | BK040 | 50 ASSAY |
販売終了 |
PAK-PBD, agarose bead, Human |
CYT | PAK02-A | 1*500 UG |
CYT社 PAK02A 2*500 を参照 |
PAK-PBD, agarose bead, Human |
CYT | PAK02-B | 4*500 UG |
CYT社 PAK02B 6*500 を参照 |
Rhotekin-RBD on agarose beads |
CYT | RT02-A | 2*2 MG |
¥218,000 |
Rhotekin-RBD on agarose beads |
CYT | RT02-B | 6*2 MG |
お問い合わせ |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













