
プロフィリン: アクチン結合タンパク質の多機能な役割 CYTOSKELETON NEWS 2017年12月号

プロフィリン: アクチン結合タンパク質の多機能な役割
タンパク質のプロフィリン (Pfn) ファミリーは、元来アクチン重合の調節因子と考えられ研究されてきました。1976年1,2に最初に同定されたこの小タンパク質 (14〜17 kDa) は、ヒトでは4種のアイソフォームが存在します (Pfn1〜4) 3。Pfn1はほとんどの細胞種で発現し、Pfn2は主に脳に局在し、Pfn3とPfn4は精巣に局在します4。Pfn発現は、マウスでは胚発生に必須です5,6。しかしながら、40年経った今も、プロフィリンタンパク質が関わるアクチン重合制御、ポリホスホイノシチドへの結合を介した細胞内シグナル伝達経路の活性化3,6、微小管末端新陳代謝7、ポリ-L-プロリンドメインを介したリガンド結合3,6、および腫瘍形成能を抑制する可能性など、未だ精査される余地があります8-10。本稿では、プロフィリンが関与するさまざまな生物学的相互作用や、これらの相互作用がアクチン重合にどのように影響を与えるかについて考察します。
プロフィリンとアクチン重合
細胞内の輸送、運動性、分裂、および成長といった細胞プロセスには、アクチン細胞骨格の再構築が必要です。プロフィリンはアクチン重合を調節し、アクチン重合の阻害や促進を行います11。プロフィリンは、単量体のG-アクチンと1:1の比率で結合親和性0.1 µMで結合し、成長しているフィラメントへ、G-アクチンが取り込まれるのを効率的に隔絶します(図1)。注目すべき点として、プロフィリンの細胞内濃度は10〜80 µMと推定されており、これは細胞内に存在する高濃度のG-アクチンを維持するためには十分量ではありません12-14。プロフィリンは、親和性は低い(25 µM)ものの、F-アクチンの反矢じり端にも結合できます15-17。さらにPfn1は、G-アクチン上のADPについて、ATPへのヌクレオチド交換を1000 倍へと触媒するため、これにより反矢じり端成長に向けたATP-G-アクチンの貯えが再び供給されます6, 18, 19。実際、アクチンフィラメントの反矢じり端が露出すると、アクチンフィラメントの反矢じり端上にATP-アクチンを積み込み、引き続き結合したプロフィリンタンパク質を解離することで、ATP-アクチン:プロフィリン複合体がフィラメント伸長を促進します6, 17。しかしながら、アクチン重合体の反矢じり端に結合した末端キャップ形成タンパク質の存在下では、プロフィリンがアクチンフィラメント形成を阻止し、F-アクチン脱重合化を促進するアクチン隔離タンパク質として作用することがin vitroで観察されています11, 20。F-アクチンの脱重合化は、in vivoにおいてもプロフィリンを、Swiss 3T3線維芽細胞またはラット腎細胞へ微量注入することで観察されています21。
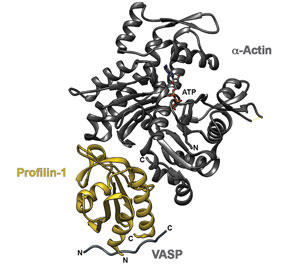
図1. ヒトプロフィリン-1(黄色)が、α -アクチン(灰色)の反対側とヒトVASPのポリプロリン由来ペプチドに結合した結晶構造。画像はUCSF Chimera30(PDB 2PAV)により作製した。
プロフィリンが促進および阻害するアクチン重合化の正確な分子機構は複雑であるものの、プロフィリンはアクチン核形成促進因子であるforminやArp2/3複合体の活性制御において門番役として作用するように思われます22。Forminが直鎖状で枝分かれしていないフィラメントを方向付けるのに対し、Arp2/3複合体とWASPのVCAドメインは枝分かれしたアクチンフィラメントの核形成を刺激します。近年の研究では、プロフィリンはformin介在性のアクチン重合を好み、Arp2/3介在性のアクチン重合を阻害することが示されています22,23 。プロフィリン介在性Arp2/3活性阻害の根底にある正確な分子メカニズムはわからないものの、プロフィリンがformin介在性活性に向けてアクチン単量体を提供しつつ、アクチン単量体結合において直接的または間接的にWASPのVCAドメインと競合しているのではないかと推測されます23。
プロフィリンとホスホイノシチド結合
ポリホスホイノシチドは、プロフィリンと相互作用して、少なくとも部分的にアクチン重合を調節します。プロフィリンは、ホスファチジルイノシトール 4, 5-二リン酸(PI(4,5) P2)およびホスファチジルイノシトール(3,4,5)-三リン酸(PI(3,4,5) P3)の両方と相互作用します24-26。 PI(4,5)P2がプロフィリンに結合することで、プロフィリンのG-アクチンへの結合が妨げられ、結果としてArp2/3介在性の枝分かれフィラメント形成に向けたG-アクチンの貯蔵が増大すると考えられています。あるいは、PI(4,5)P2がリン酸化ホスホリパーゼCにより加水分解されることでプロフィリンが増大し、これによりG-アクチンの貯蔵が減少してformin介在性アクチン重合化が促進されます27。これまでのところ、ホスホイノシチドが介在する、プロフィリンに制御されたアクチン構築の調節は、in vitroでのみ観察されています。
プロフィリンとポリ-L-プロリン
プロフィリンはまた、アクチン結合ドメインとは異なる自身のN-およびC-末端らせん体を介してポリ-L-プロリン伸展を認識します(図1)。プロフィリンの持つポリ-L-プロリン結合能によって、複数の生物種において50種類以上のリガンドに結合することができます6。 プロフィリン結合パートナーには、アクチン制御に関与するものがある一方で、エンドサイトーシス、核外輸送、およびRac/Rhoエフェクタータンパク質シグナル伝達に関与する、新たに発見されたパートナーもあります6。結合パートナーが大いに多様なことから、プロフィリンは他の非アクチン関連経路により制御される、または関与している可能性が示唆されます。これらの相互作用の生理学的な関連性はよくわかっておらず、解明が待たれます。
プロフィリンとがん
アクチン細胞骨格における動的変化は、転移とがん細胞浸潤において生じます。Pfn1発現レベルが高い複数の乳がん細胞株では、腫瘍形成能、運動性、および侵襲性の低下が見られます8,28。あるひとつの乳がん細胞株ではプロフィリンのアクチンへの結合が低下しており、腫瘍形成能抑制の低下が見られます29。いくつかの乳がん細胞株や同所性がん系ではプロフィリンの過剰発現により侵襲性の低下が見られます8,28。これらの結果より、プロフィリンによる細胞骨格動力の調節は、がん細胞増殖や遊走抑制に重要な役割を担い、そのためさらなる研究が必要であることが示唆されます。
まとめ
何十年にもおよぶ研究にも関わらず、アクチン結合タンパク質であるプロフィリンの機能性や結合パートナーは完全には理解されていません。実際、プロフィリンはアクチンに対して複雑な制御を行い、アクチンフィラメント形成の阻害と促進の両方を行うことができます。最近の報告はさらに興味をそそるもので、プロフィリンの機能はアクチン細胞骨格動力の制御をはるかに超え、微小管動力の制御、プロリンドメイン含有リガンドへの結合、およびポリホスホイノシチドへの結合を介した多数の細胞内シグナル伝達経路の活性化といった役割をも担うことが示唆されています。さらにプロフィリンは、抗がん治療における薬物標的としての可能性も含んでいます。研究者の方々がプロフィリンの様々な機能や結合パートナーを解明できるよう、Cytoskeleton社では精製アクチンや、プロフィリンを始めとするアクチン結合タンパク質、Acti-stainファロイジン、機能解析キット、およびF-アクチンイメージングプローブ (SiRシリーズ、SiR700シリーズ)をご提供しています。
- Carlsson L. et al. 1976. Crystallization of a non-muscle actin. J. Mol. Biol. 105, 353-366.
- Carlsson L. et al. 1977. Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells. J. Mol. Biol. 115, 465-483.
- Krishnan K. and Moens P.D.J. 2009. Structure and functions of profilins. Biophys. Rev. 1, 71-81.
- Aspenström P. 2010. Formin-binding proteins: modulators of formin-dependent actin polymerization. Biochim. Biophys. Acta. 1803, 174-182.
- Witke W. et al. 2001. Profilin I is essential for cell survival and cell division in early mouse development. Proc. Natl. Acad. Sci. U.S.A. 98, 3832-3836.
- Witke W. 2004. The role of profilin complexes in cell motility and other cellular processes. Trends Cell Biol. 14, 461-469.
- Nejedla M. et al. 2016. Profilin connects actin assembly with microtubule dynamics. Mol. Biol. Cell. 27, 2381-2393.
- Janke J. et al. 2000. Suppression of tumorigenicity in breast cancer cells by the microfilament protein profilin 1. J. Exp. Med. 191, 1675-1686.
- Adami G.R. et al. 2017. A loss of profilin-1 in late-stage oral squamous cell carcinoma. J. Oral Pathol. Med. 46, 489-495.
- Schoppmeyer R. et al. 2017. Human profilin 1 is a negative regulator of CTL mediated cell-killing and migration. Eur. J. Immunol. 47, 1562-1572.
- Yarmola E.G. and Bubb M.R. 2006. Profilin: emerging concepts and lingering misconceptions. Trends Biochem. Sci. 31, 197-205.
- Southwick F.S. and Young C.L. 1990. The actin released from profilin--actin complexes is insufficient to account for the increase in F-actin in chemoattractant-stimulated polymorphonuclear leukocytes. J. Cell Biol. 110, 1965-1973.
- Moldovan N.I. et al. 1997. Regulation of endothelial cell adhesion by profilin. Curr. Biol. 7, 24-30.
- Pernier J. et al. 2016. Profilin interaction with actin filament barbed end controls dynamic instability, capping, branching, and motility. Dev. Cell. 36, 201-214.
- Perelroizen I. et al. 1994. Interaction of profilin with G-actin and poly(L-proline). Biochemistry. 33, 8472-8478.
- Vinson V.K. et al. 1998. Interactions of Acanthamoeba profilin with actin and nucleotides bound to actin. Biochemistry. 37, 10871-10880.
- Shekhar S. et al. 2016. Regulators of actin filament barbed ends at a glance. J. Cell Sci. 129, 1085-1091.
- Tilney L.G. et al. 1983. Actin from Thyone sperm assembles on only one end of an actin filament: a behavior regulated by profilin. J. Cell Biol. 97, 112-124.
- Pring M. et al. 1992. Profilin-actin complexes directly elongate actin filaments at the barbed end. Biochemistry. 31, 1827-1836.
- Bubb M.R. et al. 2003. Depolymerization of actin filaments by profilin. Effects of profilin on capping protein function. J. Biol. Chem. 278, 24629-24635.
- Hájková L. et al. 1997. Characterization of a mutant profilin with reduced actin-binding capacity: effects in vitro and in vivo. Exp. Cell Res. 234, 66-77.
- Rotty J.D. et al. 2015. Profilin-1 serves as a gatekeeper for actin assembly by Arp2/3-dependent and -independent pathways. Dev. Cell. 32, 54-67.
- Suarez C. et al. 2015. Profilin regulates F-actin network homeostasis by favoring formin over Arp2/3 complex. Dev. Cell. 32, 43-53.
- Lassing I. and Lindberg U. 1985. Specific interaction between phosphatidylinositol 4,5-bisphosphate and profilactin. Nature. 314, 472-474.
- Fedorov A.A. et al. 1994. X-ray structures of isoforms of the actin-binding protein profilin that differ in their affinity for phosphatidylinositol phosphates. Proc. Natl. Acad. Sci. U.S.A. 91, 8636-8640.
- Chaudhary A. et al. 1998. Probing the phosphoinositide 4,5-bisphosphate binding site of human profilin I. Chem. Biol. 5, 273-281.
- Bezanilla M. et al. 2015. Cytoskeletal dynamics: a view from the membrane. J. Cell Biol. 209, 329-337.
- Zou L. et al. 2007. Profilin-1 is a negative regulator of mammary carcinoma aggressiveness. Br. J. Cancer. 97, 1361-1371.
- Wittenmayer N. et al. 2004. Tumor suppressor activity of profilin requires a functional actin binding site. Mol. Biol. Cell. 15, 1600-1608.
- Pettersen E.F. et al. 2004. UCSF Chimera--a visualization system for exploratory research and analysis. J. Comput. Chem. 25, 1605-1612.
Actin Products
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Profilin 1, Human |
CYT | PR02-A | 1*100 UG |
¥69,000 |
Profilin 1, Human |
CYT | PR02-B | 1*500 UG |
¥141,000 |
Profilin 1, Human |
CYT | PR02-XL2 | 1*1 MG |
¥297,000 |
Actin Protein (skeletal muscle, >95% pure), Rabbit, Unlabeled |
CYT | AKL95-B | 1*1 MG |
¥35,000 |
Actin Protein (skeletal muscle, >95% pure), Rabbit, Unlabeled |
CYT | AKL95-C | 5*1 MG |
¥137,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-A | 4*250 UG |
¥73,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-B | 2*1 MG |
¥87,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-C | 5*1 MG |
¥177,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-D | 10*1 MG |
¥335,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-E | 20*1 MG |
お問い合わせ |
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥182,000 |
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥182,000 |
Acti-stainTM 488 phalloidin, Plant |
CYT | PHDG1-A | 1*500 UL [300 slides] |
¥79,000 |
Acti-stainTM 555 phalloidin, Mushroom |
CYT | PHDH1-A | 1*500 UL [300 slides] |
¥79,000 |
Phalloidin; Fluorescent Derivatives (Acti-StainTM 535), Rhodamine Isothiocyanate |
CYT | PHDR1 | 1*500 UL [300 slides] |
¥79,000 |
Actin Biochem Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Binding Protein Spin-down Biochem Kit (for muscle) |
CYT | BK001 | 1 KIT [30-100 assays] |
¥268,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥272,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥304,000 |
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥264,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













