
記事ID : 34400
なぜ K-Ras は発がん特異性を示すのか? CYTOSKELETON NEWS 2018年6月号

なぜ K-Ras は発がん特異性を示すのか?
Ras GTPaseは、細胞増殖経路を調節し、発がん および がん細胞の移動や浸潤における重要な分子となります1-4。H-Ras および N-Ras、K-Ras4A、K-Ras4 の4つの Rasアイソフォーム(選択的スプライシングに起因する)は、30年以上前にヒト腫瘍において発がん活性化を示すことが同定されました1,2。活性化Ras変異は、単一のアミノ酸置換(例えば、G12C、G12V、G12D)によるものであり、全てのヒトがんの約30%で同定されています5-7。
グアニン交換因子 (GEF) の媒介による GDP の GTP への変換を介して、同じシグナリング経路がすべての Rasアイソフォームを活性化し、その後同じエフェクタータンパク質に結合します。しかしながら、Ras発がん性アイソフォームは、K-Rasアイソフォームを好む発がん特異性を有する様々ながん において特異的に発現されます2,8-11。実際、K-Rasは最も一般的な変異型Rasアイソフォーム(Ras変異の86%)であり、ヒトがん の21%以上と相関しています5。特に、K-Ras は、米国における死亡率が最も高い 4つのがん のうち 3つ、肺癌、結腸癌および膵臓癌において、優勢または排他的な Ras変異遺伝子です5。ほとんどの場合、K-Ras4B は、K-Ras 関連がん において最も重要な変異アイソフォームです8。本ニュースレターでは、K-Ras 発がん特異性の生物学的基礎について潜在的な解釈を考察いたします。
Rasの膜サブドメイン局在
Ras の GEF媒介性活性化およびその後の下流エフェクターとの相互作用のため、Ras はまず始めに原形質膜の内側表面上の異なるサブドメインに輸送され、挿入され、固定されなければなりません(ナノクラスター化)。局在はアイソフォーム特異的であり、超可変領域 (HVR) として知られる C末端領域内の各アイソフォーム個別の脂質翻訳後修飾(修飾例:パルミトイル化、ファルネシル化、ゲラニルゲラニル化)によって決定されます2,6,1012 (図1)。パルミトイル化は、脂質ラフトや液体秩序相膜 (liquid-ordered phase membranes) のような脂質ミクロドメインへの膜挿入に有利に働きます。ファルネシル化およびゲラニルゲラニル化は、主に、液体秩序相膜への膜挿入を有利にします。H-Ras は 1つのファルネシルおよび 2つのパルミトイルの脂質修飾を有しますが、N-Ras および K-Ras4A は 1つのパルミトイルのみ有します。対照的に、K-Ras4B は 1つのファルネシルと荷電した多塩基性HVR しか持ちません(図1)。K-Ras 独自の脂質PTMプロファイルは、H-Ras および N-Ras が好む膜組成とは反対の無秩序な酸性膜を好みます2,6,10-12。PTM および結果として得られる膜内の立体配座においての違いが、エフェクター結合親和性に影響を及ぼし得ます。そして、エフェクタータンパク質と相互作用する同じ触媒ドメイン表面も原形質膜と関与する可能性があります12。また、GTP結合状態でさえ、K-Ras の触媒ドメインが膜に面している場合は、エフェクター結合親和性が損なわれる可能性があります13。
K-Ras は、ユビキチンおよびリン酸化PTM によっても制御されます。定常状態では、脱ユビキチン化酵素 USP17 は、野生型および突然変異型H および N-Ras の機能性膜局在を阻害します。しかし、定常状態および上皮成長因子 (EGF) 刺激条件下では、K-Rasの膜局在化を容認します14。また、リン酸化は K-Ras4B の膜結合およびクラスター化に対して負の調節を行います2,15-17。
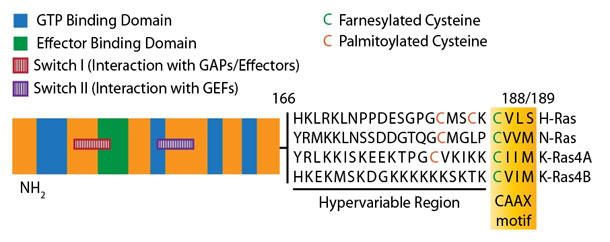
図1. Rasアイソフォームの一次構造 (出典:参考文献2)
エフェクタータンパク質の結合および下流の経路
活性Ras の下流にある 2つの主要な生理学的および腫瘍学的シグナル伝達カスケードは、 マイトジェン活性化プロテインキナーゼ (MAPK) 経路およびホスホイノシチド-3-キナーゼ (PI3K) 経路です12。原形質膜に固定された活性Rasアイソフォームは、Raf-1二量体化を促進し、MAPK を活性化します。活性化型 K- および H-Rasナノクラスターは Raf-1 をリクルートしますが、それは K-Rasナノクラスター内にのみ保持され、K-Ras を H-Ras よりも強力な Raf-1活性化剤にします18,19。PI3K に関して、K-Ras は他のアイソフォームよりも弱い活性化因子ではありますが18、受容体チロシンキナーゼ (RTK) 刺激の非存在下で PI3K を活性化する可能性があります12,20,21。
K-Ras4B は、Akt の PDGF 媒介活性化およびその後の細胞移動の増強にも特に必要とされます22。この経路は、カルモジュリン (CaM) を必要とし、成長因子媒介の Akt 活性化における CaM の役割においても、PDGF 刺激性の K-Ras / CaM-Ca2+ 複合体形成の増加を伴う可能性がある K-Ras4B を必要としています22。
明確な結合パートナー
研究者らは、K-Ras 独自の発がん特異性を仲立ちする少なくとも 1つのユニーク なK-Ras 結合パートナーが存在すると考えています。その候補は、CaM-Ca2+複合体およびPDEδです12,20,21。 CaM-Ca2+ は、HVRファルネシル部分を有するK-Ras4Bアイソフォームにのみ結合し、CaM 上のポケットに Ca2+ 依存的にドッキングします20-24。この結合は膜から K-Ras4B を取り外します24,25。 CaM-Ca2+ / K-Ras4B 複合体はまた、発がん性 K-Ras4B が細胞増殖経路を活性化する可能性のある経路を提供します。生理学的条件下では、Ras媒介 PI3K シグナル伝達は、RTK 刺激の存在下でのみ関与します。しかし、CaM-Ca2+は PI3K に結合して活性化することができ26、K-Ras4B のみがCaM-Ca2+に結合することが可能なため、研究者たちは、「K-Ras4B / CaM-Ca2+ / PI3K複合体が形成し、 CaM-Ca2+複合体が、正常な RTK が媒介する Ras-PI3K シグナル伝達カスケードの活性化と置き換わることができるようになるのではないか」と提案しています。このシナリオにおいて、発がん性 K-Ras4B 変異体は、生理学的 RTK 刺激の非存在下で細胞増殖経路を活性化することができました12,20,21。さらに、CaM-Ca2+への K-Ras の結合は、非カノニカルなWnt / Ca2 + シグナル伝達を抑制し、K-Ras 媒介性腫瘍形成の促進をもたらします27。
別のユニークな K-Ras4B 結合パートナーは PDEδであり、これは膜への K-Ras4B の輸送に関与し、H-、N- および K-Ras4A は小胞に依存します12,24,28,29。したがって、PDEδの有用性は、K-Ras 輸送およびその後の膜局在化および機能を調節し得ることです。
まとめ
なぜ K-Ras に対する発がんバイアスがあるのだろうか?という疑問が根強く残っています。上記で述べた高次構造、局在、および結合パートナーの違いに加えて、K-Ras は、K-Ras4B ノックアウト動物研究によって示唆されているように、独自の発生的役割に寄与する可能性があります2,30,31。いずれの場合でも、Ras により誘導された がんの最大割合を緩和するために、臨床腫瘍学データは、Rasタンパク質、特に K-Ras4B を標的とすることの重要性を示しています。Cytoskeleton 社は、生理学的および腫瘍学的プロセスにおけるすべての Rasアイソフォームの役割をよりよく理解するために、様々なRasタンパク質およびアッセイキットを提供しています。
参考文献
- Wang W. et al. 2012. Ras inhibition via direct Ras binding- is there a path forward? Bioorg. Med. Chem. Lett. 22, 5766-5776.
- Castellano E. and Santos E. 2011. Functional specificity of Ras isoforms: So similar but so different. Genes Cancer.2, 216-231.
- Zhou B. et al. 2016. The role of wild type RAS isoforms in cancer. Semin. Cell Dev. Biol. 58, 60-69.
- Zhang F. and Cheong J.K. 2016. The renewed battle against RAS-mutant cancers. Cell Mol. Life Sci. 73, 1845-1858.
- Baines A. et al. 2011. Inhibition of Ras for cancer treatment: The search continues. Future Med. Chem. 3, 1787-1808.
- Bos J.L. 1989. ras oncogenes in human cancer: A review. Cancer Res. 49, 4682-4689.
- Prior I.A. et al. 2012. A comprehensive survey of Ras mutations in cancer. Cancer Res. 72, 2457-2467.
- Newlaczyl A.U. et al. 2017. Quantification of spatiotemporal patterns of Ras isoform expression during development. Sci. Rep. 7, 41297.
- Hobbs G.A. et al. 2016. RAS isoforms and mutations in cancer at a glance. J. Cell Sci. 129, 1287-1292.
- Nakhaeizadeh H. et al. 2016. The RAS-effector interface: isoform-specific differences in the effector binding regions. PLoS One. 11, e0167145.
- Parker J.A. and Mattos C. 2015. The Ras-membrane interface: isoform-specific differences in the catalytic domain. Mol. Cancer Res. 13, 595-603.
- Nussinov R. et al. 2018. Oncogenic Ras isoforms signaling specificity at the membrane. Cancer Res. 78, 593-602.
- Jang H. et al. 2016. The higher level of complexity of K-Ras4B activation at the membrane. FASEB J. 30, 1643-1655.
- de la Vega M. et al. 2010. The deubiquitinating enzyme USP17 blocks N-Ras membrane trafficking and activation but leaves K-Ras unaffected. J. Biol. Chem. 285, 12028-12036.
- Bivona T.G. et al. 2006. PKC regulates a farnesyl-electrostatic switch on K-Ras that promotes its association with Bcl-XL on mitochondria and induces apoptosis. Mol. Cell. 21, 481-493.
- Cho K.-J. et al. 2016. AMPK and endothelial nitric oxide synthase signaling regulates KRas plasma membrane interactions via cyclic GMP-dependent protein kinase 2. Mol. Cell. Biol. 36, 3086-3099.
- Zhang S.Y. et al. 2017. Phosphorylation weakens but does not inhibit membrane binding and clustering of K-Ras4B. ACS Chem. Biol. 12, 1703-1710.
- Yan J. et al. 1998. Ras isoforms vary in their ability to activate Raf-1 and phosphoinositide 3-kinase. J. Biol. Chem.273, 24052-24056.
- Plowman S.J. et al. 2008. Electrostatic interactions positively regulate K-Ras nanocluster formation and function. Mol. Cell. Biol. 28, 4377-4385.
- Nussinov R. et al. 2015. The key role of calmodulin in KRAS-driven adenocarcinomas. Mol. Cancer Res. 13, 1265-1273.
- Nussinov R. et al. 2017. Calmodulin and PI3K signaling in KRAS cancers. Trends Cancer. 3, 214-224.
- Liao J. et al. 2006. Growth factor-dependent AKT activation and cell migration requires the function of c-K(b)-Ras versus other cellular Ras isoforms. J. Biol. Chem. 281, 29730-29738.
- Villalonga P. et al. 2001. Calmodulin binds to K-Ras, but not to H- or N-Ras, and modulates its downstream signaling. Mol. Cell Biol. 21, 7345-7354.
- Sperlich B. et al. 2016. Regulation of K-Ras4B membrane binding by calmodulin. Biophys. J. 111, 113-122.
- Fivaz M. and Meyer T. 2005. Reversible intracellular translocation of KRas but not HRas in hippocampal neurons regulated by Ca2+/calmodulin. J. Cell Biol. 170, 429-441.
- Joyal J.L. et al. 1997. Calmodulin activates phosphatidylinositol 3-kinase. J. Biol. Chem. 272, 28183-28186.
- Wang et al. 2015. K-Ras promotes tumorigenicity through suppression of non-canonical Wnt signaling. Cell. 163, 1237-1251.
- Weise et al. Dissociation of the K-Ras4B/PDEδ complex upon contact with lipid membranes: membrane delivery instead of extraction. J. Am. Chem. Soc. 134, 11503-11510.
- Chandra A. et al. 2011. The GDI-like solubilizing factor PDEδ sustains the spatial organization and signalling of Ras family proteins. Nat. Cell Biol. 14, 148-158.
- Bar-Sagi D. 2001. A Ras by any other name. Mol. Cell. Biol. 21, 1441-1443.
- Potenza N. et al. 2005. Replacement of K-Ras with H-Ras supports normal embryonic development despite inducing cardiovascular pathology in adult mice. EMBO Rep. 6, 432-437.
タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras: H-Ras His Protein: Wild type |
CYT | RS01-A | 1*100 UG |
¥137,000 |
N-Ras Protein; wild-type, Human |
CYT | CS-RS02 | 1*100 UG |
¥139,000 |
K-Ras4B Protein: wild-type, Human |
CYT | CS-RS03 | 1*100 UG |
¥139,000 |
K-Ras4B Mutant Protein: G12V, Human |
CYT | CS-RS04 | 1*100 UG |
¥139,000 |
| SOS1, Human | CYT | CS-GE02 | 1*100 UG |
販売終了 |
Ras-GRF, Human |
CYT | CS-GE03 | 1*100 UG |
¥131,000 |
アッセイキット
[商品詳細]
- 活性型低分子量Gタンパク質 プルダウンアッセイ Biochem Kit™
- 翻訳後修飾の解析にプルダウンで簡単に検出 - RhoGEF exchange アッセイキット
- GTPase(GTPアーゼ)のヌクレオチド交換を蛍光により測定 - G-LISA® 活性型低分子量Gタンパク質定量キット
- 少量のサンプルから、3時間以内で測定
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
RhoGEF Exchange Assay |
CYT | BK100 | 1 KIT [60-300 assays] |
¥227,000 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













