
記事ID : 11449
アクチン修飾と細胞骨格 CYTOSKELETON NEWS 2013年6月号

アクチン修飾と細胞骨格
アクチンは、高度に発現・偏在する細胞骨格タンパク質で、少なくとも17種類の翻訳後修飾(PTM;post-translational modifications)を受ける基質でもあります1。PTMは、タンパク質中のアミノ酸残基に化学基もしくは別のタンパク質が付加することにより、そのタンパク質の機能的な特性を変化させる、非常にダイナミックなプロセスで、多くの場合可逆的です。細胞の成長、運動性、輸送、分裂における役割と合わせて、アクチンの機能がPTMによってどのように変化するかを理解することは、必要不可欠です。本稿では、アクチンのPTMのうち重要な3種類(アルギニン化、グルタチオン化、リン酸化)について知られていることをまとめました(図1)。
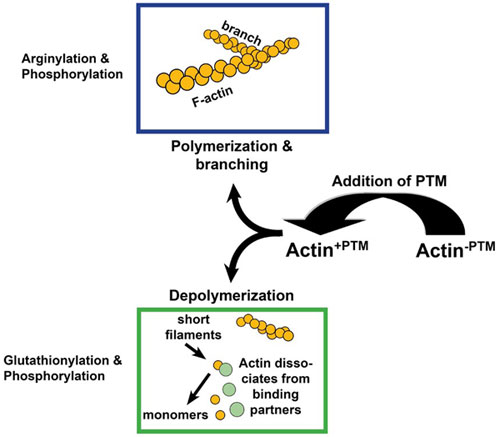
図1 翻訳後修飾(PTM)がアクチン活性に与える影響
アルギニン化は重合を促進し、グルタチオン化はそれを減少させる。リン酸化は修飾した残基に依存して重合の増加も減少もさせることができる。リン酸化はアクチンの結合にも影響する。
アルギニン化
アルギニン化は、アルギニン転移酵素(Ate1)により媒介され、βアクチンのN末端にペプチド結合によりアルギニンが付加されることで起こります2,3。アルギニン化は、いくつかの方法でアクチンの機能に影響を与えます。例えば、アルギニン化によりアクチンの重合が増加し3,4、樹状突起の形態とサイズを維持するための重要な構造であるアクチンフィラメントネットワーク5を強化します3。アルギニン化の妨害/欠損は、細胞の移動や筋線維収縮の障害4,6-8、先端ラメラの崩壊、F-アクチンレベルの減少3に関係しています。先端の崩壊は、特にβアクチンのN末端でアルギニン化が減少することに起因します4。N末端のほかにも、アクチン分子の内部で、少なくとも2つの残基でアルギニン化が起こります1。内部のアルギニン化は、アクチンとアクチンが結合するタンパク質との相互作用や重合に影響を与えると予測されています1。Ate1ノックアウトマウスの線維芽細胞培養を用いたEx vivoでの研究でも、アクチンの機能におけるアルギニン化の役割が支持されました。細胞は、重合速度が遅くなり(早い核形成/遅い伸張)、Fアクチンの染色が減少し、アクチンフィラメントが短くなり、細胞内アクチン凝集数が増加しました(図1)。In vivoでは、Ate1ノックアウトマウスは心血管発生9、神経提の形態形成7に障害がありました。
グルタチオン化
グルタチオン化は、多数の還元酸化反応(redox;reduction-oxidation)PTMのうちの1つで、アクチン中の2つのシステインアミノ酸残基(Cys217、Cys374)をターゲットとします1。グルタチオン化は、可逆的なPTMで、ジスルフィド結合によりアクチンのシステイン残基に結合し、グルタチオンジスルフィドを形成します。アクチンのグルタチオン化は、アクチン及び細胞を酸化ストレスから保護します10-12。例えば、アクチンのグルタチオン化は、酸化ストレス時の軸索・樹状突起の安定化及びニューロンの生存に関与していると考えられています11。さらに、アクチンのグルタチオン化は、アクチンの重合、輸送、Fアクチンの再編成を介して成長因子に応答するアクチンネットワークに影響しています13。酸化ストレスの間、アクチン重合を減少させるグルタチオン化が増加し、Fアクチンレベルを低下させます1,13(図1)。Fアクチンの形成を阻害するほか、グルタチオン化の増加はアクチンフィラメントの異常な再編成につながります12,24。グルタチオン化を逆行させると、アクチン重合は増加します13。
リン酸化
アクチンには、リン酸化によって修飾されるアミノ酸残基が少なくとも35個あります。このPTMは、重合に対して正と負の両方の効果を及ぼすことができます1。例えば、粘菌Dictyostelium属では、アクチンのTyr53残基がリン酸化されると、アクチンのサブユニット間の接触が妨害され、重合が減少します15,16。逆に、粘菌Physarum属では、カルシウム依存酵素のアクチンフラグミンキナーゼ(AFK)がアクチンのThr201-203残基をリン酸化し、これによってアクチンフィラメントが伸長します17-20。この伸長は、フラグミンとアクチン間の相互作用の減少の結果によると考えられています。フラグミンは、アクチンフィラメントを切断するタンパク質であるゲルソリンと関係しており、フィラメントの長さを調節しています17-20。Thrのリン酸化の効果は、プロテインホスファターゼ(PP1及びPP2A)によって逆行されます21。どちらの生物においても、アクチンのリン酸化状態の変化は、細胞外事象(例:移動、食作用、シグナル伝達)や休止状態への移行に対する細胞骨格応答に関連しています1,15-18。
哺乳類では、プロテオミクス解析により、多数のキナーゼがアクチンをリン酸化し、細胞種、病状、外刺激によって変化していることが明らかになりました。残念ながら、多くの研究は相関的で、所定のキナーゼとアクチンリン酸化との直接的な関係を報告していません1。例えば、アクチンのSer残基とTyr残基は、インスリンに応答し、未知のキナーゼを介してリン酸化され、DNase I 結合を減少させます1(図1)。また、p21活性化キナーゼPAK1は、アクチンをリン酸化することで、ストレスファイバーの欠損やFアクチンの局在化の変化に関係しています22。同様に、Srcキナーゼによるアクチンリン酸化は、アクチンの重合を阻害します1,23。アクチンキナーゼとして既知のものに、カゼインキナーゼ I1,24、cAMP依存プロテインキナーゼ(PKA)、カルシウム/ホスホイノシチド依存プロテインキナーゼ(PKC)があります25,26。カゼインキナーゼ Iは、AFKと同様にアクチンをリン酸化します(ThrとSer残基をターゲットとし、カルシウム依存的)。PKAとPKCは、正反対の機能を持ち、前者は重合を阻害し、後者が重合を促進します27,28(図1)。
アクチンは、主要な細胞骨格タンパク質で、様々なPTMによってその機能が調節されています。細胞生物学の全ての面においてアクチンが関連しているにも関わらず、少なくとも17種類の異なるPTMがどのようにアクチンの重合、安定性、結合に影響を与えるかについての理解は完全ではありません。新しいPTMツールが開発されることにより、アクチンだけでなく、他の多くの細胞骨格タンパク質のPTMについての理解が大きく進むことを期待しています。
参考文献
1. J.R. Terman and A. Kashina, 2013. Post-translational modification and regulation of actin. Curr. Opin. Cell Biol. 25, 1-9.
2. E. Balzi et al., 1990. Cloning and functional analysis of the arginyl-tRNA-protein transferase gene ATE1 of Saccharomyces cerevisiae. J. Biol. Chem. 265, 7464-7471.
3. S. Saha et al., 2010. Arginylation regulates intracellular actin polymer level by modulating actin properties and binding of capping and severing proteins. Mol. Biol. Cell. 21, 1350-1361.
4. M. Karakozova et al., 2006. Arginylation of beta-actin regulates actin cytoskeleton and cell motility. Science. 313, 192-196.
5. P. Hotulainen et al., 2009. Defining mechanisms of actin polymerization and depolymerization during dendritic spine morphogenesis. J. Cell Biol. 185, 323-339.
6. R. Rai et al., 2008. Arginyltransferase regulates alpha cardiac actin function, myofibril formation and contractility during heart development. Development. 135, 3881-3889.
7. S. Kurosaka et al., 2010. Arginylation-dependent neural crest cell migration is essential for mouse development. PLoS Genet. 6, e10000878.
8. S. Kurosaka et al., 2012. Arginylation regulates myofibrils to maintain heart function and prevent dilated cardiomyopathy. J. Mol. Cell Cardiol. 53, 333-341.
9. Y.T. Kwon et al., 2002. An essential role of N-terminal arginylation in cardiovascular development. Science. 297, 96-99.
10. I. Dalle-Donne et al., 2005. S-glutathionylation in human platelets by a thiol-disulfide exchange-independent mechanism. Free Radic. Biol. Med. 38, 1501-1510.
11. M. Sparaco et al., 2006. Protein glutathionylation in human central nervous system: potential role in redox regulation of neuronal defense against free radicals. J. Neurosci. Res. 83, 256-263.
12. E.A. Sabens Liedhegner et al., 2012. Mechanisms of altered redox regulation in neurodegenerative diseases—Focus on S-glutathionylation. Antioxid. Redox Signal. 16, 543-566.
13. J. Wang et al., 2003. Stable and controllable RNA interference: Investigating the physiological function of glutathionylated actin. Proc. Natl. Acad. Sci. USA. 100, 5103-5106.
14. A. Pastore et al., 2003. Actin glutathionylation increases in fibroblasts of patients with Friedreich’s ataxia. J. Biol. Chem. 278, 2588–42595.
15. X. Liu et al., 2006. Phosphorylation of actin Tyr-53 inhibits filament nucleation and elongation and destabilizes filaments. Proc. Natl. Acad. Sci. USA. 103, 13694-13699.
16. K. Baek et al., 2008. Modulation of actin structure and function by phosphorylation of Tyr-53 and profilin binding. Proc. Natl. Acad. Sci. USA. 105, 11748-11753.
17. B. Constantin et al., 1998. Disruption of the actin cytoskeleton of mammalian cells by the capping complex actin-fragmin is inhibited by actin phosphorylation and regulated by Ca2+ ions. J. Cell Sci. 111, 1695-1706.
18. K. Furuhasi and S. Hatano, 1990. Control of actin filament length by phosphorylation of fragmin-actin complex. J. Cell Biol. 111, 1081-1087.
19. K. Furuhasi and S. Hatano, 1992. Identification of actin kinase activity in purified fragminactin complex. FEBS Lett. 310, 34-36.
20. S. Steinbacher et al., 1999. The crystal structure of the Physarum polycephalum actinfragmin kinase: an atypical protein kinase with a specialized substrate-binding domain. EMBO J. 18, 2923-2929.
21. E. Waelkens et al., 1995. Microfilament dynamics: regulation of actin polymerization by actin-fragmin kinase and phosphatases. Adv. Enzyme Regul. 35, 199-227.
22. E.A. Papakonstanti and C. Stournaras, 2002. Association of PI-3 kinase with PAK1 leads to actin phosphorylation and cytoskeletal reorganization. Mol. Biol. Cell. 13, 2946-2962.
23. C.A. Hirshman et al., 2005. Isoproterenol induces actin depolymerization in human airway smooth muscle cells via activation of an Src kinase and Gs. Am. J. Physiol. Lung Cell Mol. Physiol. 288, L924-L931.
24. T. Shibayama et al., 1986. Phosphorylation of muscle and non-muscle actins by casein kinase 1 in vitro. Biochem. Int. 13, 367-373.
25. J.M. Carrascosa and O.H. Wieland, 1986. Evidence that (a) serine specific protein kinase(s) different from protein kinase C is responsible for the insulin-stimulated actin phosphorylation by placental membrane. FEBS Lett. 201, 81-86.
26. M.P. Walsh et al., 1981. Phosphorylation of smooth muscle actin by the catalytic subunit of the cAMP-dependent protein kinase. Biochem. Biophys. Res. Comm. 102, 149-157
27. A.G. Prat et al., 1993. Activation of epithelial Na+ channels by protein kinase A requires actin filaments. Am. J. Physiol. 265, C224-C233.
28. Y. Ohta et al., 1987. Protein kinase C and cAMP-dependent protein kinase induce opposite effects on actin polymerizability. FEBS Lett. 222, 305-310.
アクチン関連研究ツール タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-A | 4*250 UG |
¥68,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-B | 2*1 MG |
¥81,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-A | 2*250 UG |
¥74,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-C | 1*1 MG |
¥125,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-A | 1*1 MG |
¥63,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-B | 5*1 MG |
¥227,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-A | 1*1 MG |
¥69,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-B | 5*1 MG |
¥324,000 |
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-A | 5*20 UG |
¥113,000 |
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-C | 20*20 UG |
¥326,000 |
アクチン関連研究ツール キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥257,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













