記事ID : 9617
上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与 CYTOSKELETON NEWS 2012年8月号

上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
分化転換とは、ある分化状態から他の分化状態へと遷移する細胞の能力のことを指します。上皮間葉転換(EMT)では、頂端/基底両極で、強固な細胞間接合をし、同一の形態という特徴を有する上皮性の表現型から、より線維芽細胞様になり細胞間接合が弱まって運動性と浸潤性が強まった、間葉系細胞の表現型への変化が起こります1,2。EMTは正常な発生においても重要な役割を有しますが、組織の線維化やがん細胞の転移等といった病態にも関与します。EMTは3種類にクラス分けされます。1型は発生の過程で生じる生理学的EMTを指します。2型EMTは創傷治癒や組織線維化に至る慢性炎症により生じます。3型EMTは腫瘍形成の際に転移細胞を生じる分化転換を指します1(図1)。EMTによって生じる明確な形態変化に加えて、核へ局在し遺伝子発現を調節するタンパク質(例:β-カテニン、Smad2/3等)があり3-5、発現量が上昇(例:ヴィメンチン、Snail1/2、RhoC、Rac1b等)あるいは低下(例:E-カドヘリン、サイトケラチン等)する細胞タンパク質も見られます。これら多数の細胞変化は、EMT発生の診断基準として汎用されています。当社報では、病理的なEMTにおける2種類のRhoファミリー低分子G-タンパク質であるRhoCとRac1bの関与に焦点を当てます。
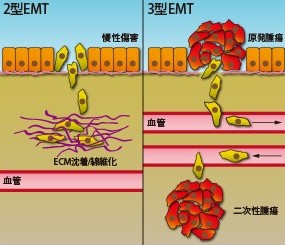
図1. 病理的EMTの2形態。慢性傷害(例:炎症)に対する2型EMT応答により、組織線維化の原因となる細胞外マトリクスの過度な沈着が生じる。3型EMTにより腫瘍細胞が転移性となり、遠位に二次性腫瘍を形成する。
RhoCは、アミノ酸配列で85%の相同性を有する3種のRho GTPaseアイソフォーム(RhoA, RhoB, RhoC)のうちの1種です6。各腫瘍におけるRhoCレベルを評価した研究では、RhoC発現の増加と患者の予後不良の間に相関があることが示され4,7-10、3型EMTにおけるRhoCの役割が示唆されました。結腸癌細胞がEMTを経ると、活性型RhoCレベルが上昇し、活性型RhoAレベルが低下することは注目すべき現象です4。さらに、この様なRhoアイソフォームの相反的な制御は、EMT後の細胞における効率的な遊走に必須で、RhoC発現と活性の上昇は内皮マーカーであるE-カドヘリンの局在化不良や発現の消失と反比例します4。3型EMTにおけるRhoC機能の補助として、前EMT/前転移性マイクロRNA-10b(miR-10b)の発現が間接的にRhoC発現を誘導することが見出された一方11、EMTの発現によるmiR-138の抑制がRhoCとその下流エフェクターであるROCK2の発現を低下させます12。
Rac1bは、グアニンヌクレオチド結合に関与するスイッチII領域と隣接した部位に19アミノ酸残基が挿入した、Rac1の選択的スプライスバリアントであり、アミノ酸残基が挿入されることでこのアイソフォームは構成的に活性化され、下流エフェクタータンパク質の部分集合体へと組み込まれます13,14。Rac1bレベルの上昇は大腸腫瘍サンプルや15、アルツハイマー病患者由来サンプルで観察されます16。これは3型EMT、場合によっては2型EMTにおけるRac1bの役割を示唆しています。細胞培養実験では、マトリクスメタロプロテイナーゼ-3(MMP-3)がRac1b発現の誘導と、EMTの随伴的な誘導能を有します5。これは、EMT過程におけるRac1bの直接的な役割を示唆しています。さらに、MMP-3誘導性EMTに必須の段階である、Rac1bはミトコンドリアからの活性酸素種(ROS)の産生と放出を刺激することで前EMT転写因子であるSnail1発現の誘導を引き起こします5。
RhoCとRac1bは、病理的なEMTの過程において多様な役割を有する、非常に重要なRhoファミリー低分子量G-タンパク質です。今後の研究により、組織線維化を引き起こす2型EMTにおけるこれら低分子量G-タンパク質のさらなる機能が解明されるかどうかを確認することは、興味深いことであるといえます。
参考文献
1. Kalluri, R. and Weinberg, R.A. (2009) The basics of epithelial-mesenchymal transition. J Clin Invest. 119: 1420-1428.2. Thiery, J.P., Acloque, H., Huang, R.Y.J. and Nieto, M.A. (2009) Epithelial-mesenchymal transitions in development and disease. Cell. 139: 871-890.
3. Lee, J.M., Dedhar, S., Kalluri, R. and Thompson, E.W. (2006) The epithelial-mesenchymal transition: new insights in signaling, development, and disease. J Cell Biol. 172: 973-981.
4. Bellovin D.I., Simpson, K.J., Danilov, T., Maynard, E., Rimm, D.L., Oettgen, P. and Mercurio, A.M. (2006) Reciprocal regulation of RhoA and RhoC characterize the EMT and identifies RhoC as a prognostic marker for colon cancer. Oncogene. 25: 6959-6967.
5. Radisky, D.C., Levy, D.D., Littlepage, L.E., Liu, H., Nelson, C.M., Fata, J.E., Leake, D., Godden, E.L., Albertson, D.G., Nieto, M.A., Werb, Z. and Bissell, M.J. (2005) Rac1b and reactive oxygen species mediate MMP-3-induced EMT and genomic instability. Nature. 436: 123-127.
6. Wheeler, A.P. and Ridley, A.J. (2004) Why three Rho proteins? RhoA, RhoB, RhoC, and cell motility. Exp Cell Res. 301: 43-49.
7. van Golen, K.L. Wu, Z.F., Qiao, X.T., Bao, L.W. and Merajver, S.D. (1999) A novel putative low-affinity insulin-like growth factor-binding protein, LIBC (Lost in Inflammatory Breast Cancer), and RhoC GTPase correlate with the inflammatory breast cancer phenotype. Clin Cancer Res. 5: 2511-2519.
8. Clark, E.A., Golub, T.R., Lander, E.S. and Hynes, R.O. (2000) Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 406: 532-535.
9. Shikada, Y., Yoshino, I., Okamoto, T., Fukuyama, S., Kameyama, T. and Maehara, Y. (2003) Higher expression of RhoC is related to invasiveness in non-small cell lung carcinoma. Clin Cancer Res. 9: 5282-5286.
10. Wang, W., Yang, L.Y., Huang, G.W., Lu W.Q., Yang, Z.L., Yang, J.Q. and Liu, H.L. (2004) Genomic analysis reveals RhoC is a potential marker in hepatocellular carcinoma with poor prognosis. Br J Cancer. 90: 2349-2355.
11. Ma, L., Teruya-Feldstein, J. and Weinberg, R.A. (2007) Tumour invasion and metastasis initiated by microRNA-10b in breast cancer. Nature. 449: 682-688.
12. Jiang, L., Liu, X., Kolokythras, A., Yu, J., Wang, A., Heidreder, C.E., Shi, F. and Zhou, X. (2010) Downregulation of the Rho GTPase signaling pathway is involved in the microRNA-138-mediated inhibition of cell migration and invasion in tongue squamous cell carcinoma. Int J Cancer. 127: 505-512.
13. Matos, P., Collard, J.G. and Jordon, P. (2003) Tumor-related alternatively spliced Rac1b is not regulated by Rho-GDP dissociation inhibitors and exhibits selective downstream signaling. J Biol Chem. 278: 50442-50448.
14. Fiegen, D., Haeusler, L-C., Blumenstein, L., Herbrand, U., Dvorsky, R., Vetter, I.R. and Ahmadian, M.R. (2004) Alternative splicing of Rac1 generates Rac1b, a self-activating GTPase. J Biol Chem. 279: 4743-4749.
15. Jordon, P., Brazão, R., Boavida, M.G., Gespach, C. and Chastre, E. (1999) Cloning of a novel human Rac1b splice variant with increased expression in colorectal tumors. Oncogene. 18: 6835-6839.
16. Perez, S.E., Getova, D.P., He, B., Counts, S.E., Geula, C., Desire, L., Coutadeur, S., Peillon, H., Ginsberg, S.D. and Mufson, E.J. (2012) Rac1b increases with progressive Tau pathology within cholinergic nucleus basalis neurons in Alzheimer’s disease. Am J Path. 180: 526-540.
低分子量G-タンパク質活性化アッセイ
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Combo RhoA/Rac1/Cdc42 Activation Assay Kit |
CYT | BK030 | 1 KIT [3 x 10 assays] |
¥345,000 |
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
CYT社 BK124L 1 を参照 |
RhoA G-LISA(R) Activation Assay (luminescence) |
CYT | BK121 | 96 ASSAY |
¥317,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036 | 1 KIT [80 assays] |
CYT社 BK036L 1 を参照 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036-S | 1 KIT [20 assays] |
¥132,000 |
Rac1,2,3 G-LISA(R) Activation Assay Kit |
CYT | BK125 | 96 ASSAY |
¥317,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
CYT社 BK128L 1 を参照 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK126 | 1 KIT [96 assays] |
¥317,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
CYT社 BK035L 1 を参照 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035-S | 1 KIT [20 assays] |
¥132,000 |
Cdc42 G-LISA(R) Activation Assay Kit |
CYT | BK127 | 96 ASSAY |
CYT社 BK127L 1 を参照 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034 | 1 KIT [50 assays] |
CYT社 BK034L 1 を参照 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034-S | 1 KIT [20 assays] |
¥132,000 |
RalA G-LISA(R) Activation Assay Kit |
CYT | BK129 | 1 KIT [96 assays] |
¥317,000 |
RalA Activation Assay Biochem Kit |
CYT | BK040 | 50 ASSAY |
販売終了 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥317,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
CYT社 BK008L 1 を参照 |
Ras Activation Assay Biochem Kit |
CYT | BK008-S | 1 KIT [20 assays] |
¥132,000 |
G-タンパク質調節因子
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Rho Activator II |
CYT | CN03-A | 3*20 UG |
¥76,000 |
Rho Activator II |
CYT | CN03-B | 9*20 UG |
¥211,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-A | 1*20 UG |
¥73,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-B | 5*20 UG |
¥237,000 |
Rho/Rac/Cdc42 Activator I |
CYT | CN04-A | 3*20 UG |
¥76,000 |
Rho/Rac/Cdc42 Activator I |
CYT | CN04-B | 9*20 UG |
¥211,000 |
Rho Pathway Inhibitor I (Rho Kinase (ROCK) Inhibitor Y-27632) |
CYT | CN06-A | 5*10 UNIT |
販売終了 |
Rho Pathway Inhibitor I (Rho Kinase (ROCK) Inhibitor Y-27632) |
CYT | CN06-B | 20*10 UNIT |
販売終了 |
Rho Activator |
CYT | CN01-A | 5*10 UNIT |
¥76,000 |
Rho Activator |
CYT | CN01-B | 20*10 UNIT |
¥268,000 |
Rac and Cdc42 Activator, Mouse |
CYT | CN02-A | 5*10 UNIT |
¥76,000 |
Rac and Cdc42 Activator |
CYT | CN02-B | 20*10 UNIT |
¥268,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













