
記事ID : 33561
自閉スペクトラム症におけるGEF Trioの役割 CYTOSKELETON NEWS 2018年1月号

自閉スペクトラム症におけるGEF Trioの役割
神経発達症、自閉スペクトラム症 (ASD)などの知的障害は、神経細胞の樹状突起や樹状突起スパインの発育異常と関連があります。ASDは、行動障害が複雑に組み合わさったもので、社会的相互作用やコミュニケーションの欠陥、限定された行動パターンが特徴です。最近の研究では、世界人口の1%がASDと考えられています1。樹状突起スパインは、F-アクチンと、構造・機能が柔軟に変化するスパインとによって構成されています。RhoファミリーであるGTPアーゼが動的アクチンを制御しており、スパインはこの動的アクチンに依存しています。実際、RacとPAKのエフェクタータンパク質が、樹状突起スパインの発生・伸長・枝分かれといった、正常な脳の発達と機能の制御に必須です2-4。
最近の遺伝学の研究により、個々の知的障害者は、RhoファミリーGTPアーゼ活性化タンパク質 (GAP) などの RhoファミリーであるGTPアーゼシグナリング、セリン/スレオニンキナーゼ(PAK3)、Rac/Cdc42グアニン交換因子 (GEF) αPIX5に変異があることが分かってきました。しかも、PAK阻害因子であるFRAX486は、最も一般的な遺伝性の自閉症および認知症である脆弱X症候群 (FXS) に対する効果的な治療薬です。FRAX486は、FXS6のin vivoモデルにおいて、樹状突起スパインを正常な形態に戻し、異常行動を改善します。その上、in vivoでのASDモデルであるShank3ノックアウトマウスにおいて、Rac1の活性化により、またはアクチン脱重合タンパク質であるコフィリンを阻害することで、ASD様の表現型を改善しました7-12。
Rhoファミリーの一員であるGEF Trioは、多機能でマルチドメインを持つGEFであり、発育中の脳で広く分布しています13-15(図1)。神経細胞において最も多くTrioが発現するのは、出生前/初期の新生児期です。これは、Trioが初期の神経細胞の発育で重要な役割があることを示しています13-15。多くのTrioのアイソフォームは、場所と成長に特異的な、そのアイソフォーム独自の発現パターンを示します(図1)。海馬と皮質の神経細胞では、Trio-9は有力なアイソフォームです13,14。Trioは2つの別々のGEFドメインを通じて、RhoファミリーであるGTPアーゼのRhoAとRac1の活性化を媒介し、神経伝達において重要な、アクチンが元となる多数の構造変化を制御しています16-17。
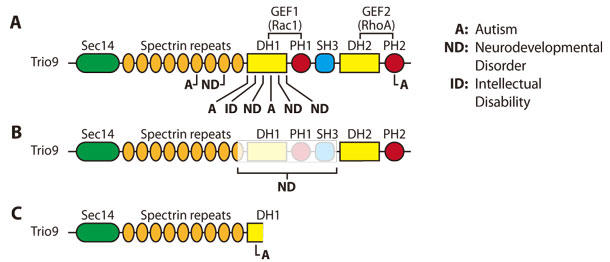
図1. Rhoファミリー GEF TrioにおけるASD関連変異
A.多ドメインにまたがるミスセンス変異 B. GEF1ドメインがすべて欠失することにより起きる16エキソンの欠失
C. 一つのヌクレオチドが欠失することでGEF1/DH1ドメインで形成されるストップコドン
∗ それぞれの変異は認知障害の診断に利用できる。(Trioのアミノ酸配列は NCBI Reference Sequence: NP_009049.2 より)
Trio/Rac1による神経伝達の制御
本稿では、Trioが媒介するRac1の活性化と、Rac1が媒介していると考えられている細胞骨格のF-アクチンの再構築と、それが元となり、海馬と皮質の樹状突起スパインにて引き起こされるグルタミン酸の作用による神経伝達の変化に焦点を当てます。
グルタミン酸による神経伝達が機能しない障害は、ASDと関連があると考えられています18-21。最近、Trio、Rac1、グルタミン酸が作用して起きる神経伝達と、ASDとの関連が研究が始まりました。海馬の培養切片の神経細胞における野生型の-の過剰発現は、AMPAレセプター(AMPAR)が媒介する興奮性シナプス後電流 (eEPSC) の上昇を引き起こし、Trioのノックダウンは逆の効果をもたらします22。重要なことは、NMDAレセプター(NMDAR) が媒介するシナプスの活動は、いずれかの処理により明確に引き起こされるわけではないことです22。逆に、海馬の培養切片の神経細胞において、shRNAのトランスフェクションによるTrioのノックダウンにより、AMPARが媒介する興奮性シナプス後電流 (eEPSC)の選択的な上昇が起きます23, 24。Trioのノックダウンは、初期の海馬の培養切片においてAMPARのエンドサイトーシスを減少させ、樹状突起スパインの伸長と枝分かれを促進します23,24。これらの効果が異なるのは、Trioの発現が減少する時点の違いに起因します。
グルタミン酸による神経伝達をTrio/Rac1が媒介して制御していることと、ASDにおける役割が分かっていることから、ASDモデルにおいてTrioの変異がどのように影響しているのかが研究がされました。Trio遺伝子のRac GEFドメイン内のいくつかの変異が、Rac1の活性を減少させ、知的障害、指の異形症、小頭症という表現型で現れる遺伝的な発達遅延と関連しています25(図1)。さらに、ASDまたはそれに関連する障害を持つ個々の患者のTrioのRac活性サブドメイン内(GEF1/DH1; 175アミノ酸)に、6箇所のde novoミスセンス変異が新たに発見され、一か所のヌクレオチドの欠失によりストップコドンが形成されていることが分かりました(図1)。
この変異によって、ASDのin vitroモデルでは、Rac1とグルタミン酸による神経伝達を活性化するために、Trioの機能の活性が低下することも上昇することもあり得ます。Trioの変異は、Rac1の活性低下をもたらし、さらにNMDARが媒介する興奮性シナプス後電流 (eEPSC) は変化しないのにもかかわらず、沈静したシナプス(たとえば、AMPARを全く持たないシナプス)の数が増加することで、AMPARが媒介する興奮性シナプス後電流 (eEPSC)の低下をもたらします。グルタミン酸によるシナプス形成の増加により、Trioの変異は、活性化されたRac1レベルとAMPARの爆発的な増加と、NMDARが媒介する興奮性シナプス後電流 (eEPSC)の爆発的な上昇をもたらします26。Trio/Rac1が媒介するグルタミン酸による神経伝達の刺激の低下と上昇は、神経の発達や認識力に逆に作用し、ASDとそれに関連する障害を診断治療する際に考慮する必要があります。
まとめ
グルタミン酸が作用するシナプスで、Rac1媒介性のアクチン細胞骨格について、変異Trioが異常な制御を行い、2方向への再構築が起きてしまうことがASDの証拠であるということが最近のデータより強く示唆されました。これによれば、Trio/Rac1シグナリングは、合流点であり、ASDとそれに関連する行動と認識障害の原因となる分子メカニズムであると言えます。ASD、神経発達障害、知的障害においてアクチン制御を行うRhoファミリーのGTPアーゼの役割を理解するために、Cytoskeleton社は精製GEFとアクチベーター、インヒビター、抗体、そして低分子 GTPアーゼの活性アッセイキットをご用意しています。また、F-アクチンの生細胞イメージングプローブ (SiRシリーズ、SiR700シリーズ)などの他の試薬やアクチン重合や結合、in vivoレベルでのモノマー対ポリマーのアクチンの研究に使えるキットもご用意しています。
参考文献
- http://www.autism-society.org/what-is/facts-and-statistics/.
- Boda B. et al. 2004. The mental retardation protein PAK3 contributes to synapse formation and plasticity in hippocampus. J. Neurosci. 24, 10816-10825.
- Asrar S. et al. 2009. Regulation of hippocampal long-term potentiation by p21-activated protein kinase 1 (PAK1). Neuropharmacology. 56, 73-80.
- Huang W. et al. 2011. P21-activated kinases 1 and 3 control brain size through coordinating neuronal complexity and synaptic properties. Mol. Cell Biol. 31, 388-403.
- Ramakers G.J.A. 2002. Rho proteins, mental retardation and the cellular basis of cognition. Trends Neurosci. 25, 191-199.
- Dolan B.M. et al. 2013. Rescue of fragile X syndrome phenotypes in Fmr1 KO mice by the small-molecule PAK inhibitor FRAX486. Proc. Natl. Acad. Sci. U.S.A. 110, 5671-5676.
- Bonaglia M.C. et al. 2001. Disruption of the ProSAP2 gene in a t(12;22)(q24.1;q13.3) is associated with the 22q13.3 deletion syndrome. Am. J. Hum. Genet. 69, 261-268.
- Moessner R. et al. 2007. Contribution of SHANK3 mutations to autism spectrum disorder. Am J. Hum. Genet. 81, 1289-1297.
- Durand C.M. et al. 2007. Mutations in the gene encoding the synaptic scaffolding protein SHANK3 are associated with autism spectrum disorders. Nat. Genet. 39, 25-27.
- Durand C.M. et al. 2012. SHANK3 mutations identified in autism lead to modification of dendritic spine morphology via an actin-dependent mechanism. Mol. Psychiatry. 17, 71-84.
- Duffney L.J. et al. 2013. Shank3 deficiency induces NMDA receptor hypofunction via an actin-dependent mechanism. J. Neurosci. 33, 15767-15778.
- Duffney L.J. et al. 2015. Autism-like deficits in Shank3-deficient mice are rescued by targeting actin regulators. Cell Rep. 11, 1400-1413.
- McPherson C.E. et al. 2005. Multiple novel isoforms of Trio are expressed in the developing rat brain. Gene. 347, 125-135.
- Portales-Casamar E. et al. 2006. Identification of novel neuronal isoforms of the Rho-GEF Trio. Biol. Cell. 98, 183-193.
- Miller M.B. et al. 2013. Neuronal RhoGEFs in synaptic physiology and behavior. Neuroscientist. 19, 255-273.
- Seipel K. et al. 1999. Trio amino-terminal guanine nucleotide exchange factor domain expression promotes actin cytoskeleton reorganization, cell migration and anchorage-independent cell growth. J. Cell Sci. 112, 1825-1834.
- Chhatriwala M.K. et al. 2007. The DH and PH domains of Trio coordinately engage Rho GTPases for their efficient activation. J. Mol. Biol. 368, 1307-1320.
- Carlson G.C. 2012. Glutamate receptor dysfunction and drug targets across models of autism spectrum disorders. Pharmacol. Biochem. Behav. 100, 850-854.
- Rojas D.C. 2014. The role of glutamate and its receptors in autism and the use of glutamate receptor antagonists in treatment. J. Neural. Transm. 121, 891-905.
- Volk L. et al. 2015. Glutamate synapses in human cognitive disorders. Annu. Rev. Neurosci. 38, 127-149.
- Bourgeron T. 2015. From the genetic architecture to synaptic plasticity in autism spectrum disorder. Nat. Rev. Neurosci. 16, 551-563.
- Herring B.E. and Nicoll R.A. 2016. Kalirin and Trio proteins serve critical roles in excitatory synaptic transmission and LTP. Proc. Natl. Acad. Sci. U.S.A. 113, 2264-2269.
- Ba W. et al. 2016. TRIO loss of function is associated with mild intellectual disability and affects dendritic branching and synapse function. Hum. Mol. Genet. 25, 892-902.
- Ba W. and Kasri N.N. 2017. RhoGTPases at the synapse: An embarrassment of choice. Small GTPases. 8, 106-113.
- Pengelly R.J. et al. 2016. Mutations specific to the Rac-GEF domain of TRIO cause intellectual disability and microcephaly. J. Med. Genet. 53, 735-742.
- Sadybekov A. et al. 2017. An autism spectrum disorder-related de novo mutation hotspot discovered in the GEF1 domain of Trio. Nat. Commun. 8, 601.
GTPase Assay kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoGEF Exchange Assay |
CYT | BK100 | 1 KIT [60-300 assays] |
¥240,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035-S | 1 KIT [20 assays] |
¥132,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
CYT社 BK035L 1 を参照 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK126 | 1 KIT [96 assays] |
¥317,000 |
Rac1 G-LISA(R) Activation Assay Kit, Trial Size |
CYT | BK128-S | 24 ASSAY |
¥200,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
CYT社 BK128L 1 を参照 |
Spirochrome™ Live Cell Imaging Probes
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥182,000 |
GEF Proteins
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
ARNO, Human |
CYT | CS-GE07 | 1*100 UG |
¥140,000 |
Dbs protein GEF domain - His tagged |
CYT | GE01-A | 2*50 UG |
¥104,000 |
Ras-GRF, Human |
CYT | CS-GE03 | 1*100 UG |
¥140,000 |
| SOS1, Human | CYT | CS-GE02 | 1*100 UG |
販売終了 |
| SOS1, Human | CYT | CS-GE02-XL | 1*1 MG |
販売終了 |
Tiam1, Human |
CYT | CS-GE04 | 1*100 UG |
¥140,000 |
Vav1, Human |
CYT | CS-GE05 | 1*100 UG |
¥140,000 |
Vav2, Human |
CYT | CS-GE06 | 1*100 UG |
¥140,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













