記事ID : 15244
有糸分裂制御タンパク質におけるSUMO化の重要性 CYTOSKELETON NEWS 2015年6月号

有糸分裂に関わるタンパク質のSUMO化: 局在と機能
はじめに
有糸分裂が正常に行われるためには、無数のタンパク質の精巧な調節と相互作用が必要となります。近年、翻訳後修飾(PTM)の一つであるSUMO化が、有糸分裂の制御に関わるタンパク質の機能調節において重要な役割を担っていることが明らかになりました1。SUMO(Small Ubiquitin-like MOdifier)タンパク質は、複数の酵素の働きにより、標的タンパク質のリジン残基に共有結合します2,3。SUMO化された有糸分裂タンパク質は、核内に高密度に局在し、逆反応である脱SUMO化、または、ユビキチンを介したタンパク質分解のいずれかによって量的に調節されると考えられています4,5。3種類のSUMOパラログ(SUMO 1, 2, 3)と SUMO-2/3 は高い相同性を有し、同一のグループに分類されます。SUMO-1 と SUMO-2/3 は、それぞれ標的となるタンパク質が異なり、機能や細胞内局在にも違いが見られます6。有糸分裂における動的なSUMOを介した経路の解析には、SUMOコンジュゲートの正確な識別が非常に重要になります。しかし、以前は高品質なSUMOタンパク質抗体が存在せず、低レベルのコンジュゲートの検出は非常に困難でした。本稿では、SUMO-2/3 による修飾が有糸分裂をどのように調節するかを簡潔に説明し、SUMO-2/3 により修飾されたタンパク質の検出に使用できる新しい抗体をご紹介します。
有糸分裂に関わるタンパク質のSUMO化による調節
SUMO化は、タンパク質の結合モチーフや安定性、輸送を変化させることにより、有糸分裂に関わるタンパク質の機能を動的に調節します。例えば、染色体パッセンジャー複合体(chromosomal passenger complex; CPC)を形成する有糸分裂期キナーゼである Aurora B7 と Borealin8 は、SUMO-2/3 によって修飾されます。Aurora B は、CPC の触媒サブユニットで、SUMO化を受けるとキナーゼ活性が亢進します7。 CPC は、染色体の紡錘体赤道面への整列、紡錘体-動原体結合、細胞質分裂などの有糸分裂イベントを調節します7,8。もう一つの重要な SUMO-2/3 によってSUMO化される有糸分裂タンパク質は、DNAトポイソメラーゼ II です。SUMO化されたトポイソメラーゼは、染色体が適切に分離されるために重要な役割を果たしています9。また、SUMO-2/3 は、動原体に局在するタンパク質である BubR1 および Nuf2 のSUMO化に関与します。これらのタンパク質は、微小管(MT)キネシンモーター分子である CENP-E とポリ SUMO-2/3 との、非共有結合性相互作用に関与すると考えられています。この翻訳後修飾は、モーターが適切に局在化して機能する(MTと動原体との結合など)ために非常に重要です。
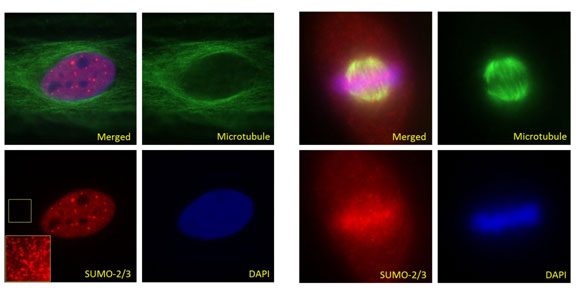
図1 間期(A: パネル左)および中期(B: パネル右)における HeLa 細胞の蛍光免疫染色。
細胞を、α/β-チューブリン抗体(ヒツジ抗チューブリン抗体、品番: ATN02、緑色)および SUMO-2/3 抗体(クローン 12F3、品番: ASM23、赤色)を用いて染色した。DNAはDAPIを用いて染色した。
有糸分裂における内在性 SUMO-2/3 の検出
SUMOコンジュゲートの発現は低レベルなため、クルードな細胞/組織ライセートからのSUMO化タンパク質の検出は非常に困難です。解析を行うには、ターゲットタンパク質の濃縮が必要となります11。免疫沈降(IP)は、効率的に濃縮できる手法ですが、SUMOタンパク質に特異的に結合する親和性の高い抗体が必要となります。近年、タンデムな SUMO 相互作用モチーフ(SUMO interacting motifs; SIMs)を利用したプルダウンアッセイにより、特異的なターゲットの検出が可能であることが報告されましたが、この方法は一般的ではなく、夾雑物による影響を受ける可能性があります12。最も一般的なのは、エピトープタグを付加したSUMO変異体を発現する細胞株を用いる方法です13。しかし、細胞株の構築には時間と手間がかかり、変異SUMOタンパク質を過剰発現させると、細胞の恒常性を乱す可能性があります。現在では、SUMO-2/3 を認識する高品質な抗体を研究にご利用いただくことが可能です。Cytoskeleton社では、2種類の SUMO-2/3 抗体を開発しました。クローン 12F3(品番: ASM23)は、WB、IF、IP などのアプリケーションにおいて、一般的に使用されているクローン 8A2 よりも優れたパフォーマンスを示します。もう一方のクローン 11G2(品番: ASM24)は、非常に高感度な免疫沈降を可能とします。IF(図1)および IP(図2)実験は、以前に報告された結果と一致しています10,11。大部分の SUMO-2/3 コンジュゲートは、間期に核に大量に局在しますが(図1A)、細胞質タンパク質もSUMO化を受けます(図1A の挿入画像を参照)。細胞が有糸分裂に入ると、数種類のSUMO化タンパク質(例: RanGAP114 および トポイソメラーゼ II9)が、動原体微小管上にはっきりと可視化されます(図1B)。IP によりSUMO化タンパク質を濃縮することで、TFII-I などの特定のターゲットの検出が(低レベルであっても)可能になります。11G2 および 12F3 抗体を用いて、HeLa細胞ライセートから SUMO-2/3 コンジュゲートを沈殿させます。トータルの沈殿物を、抗 SUMO-2/3 抗体(12F3)でイムノブロットし、特定のタンパク質(TFII-I および RanGAP1)をそれぞれに対する抗体で検出しました(図2)。興味深いことに、RanGAP1 は SUMO-111 または SUMO-2/3 のいずれかによってモノSUMO化されます。2種類の抗体を用いて沈殿させた SUMO-2/3 コンジュゲートは、それぞれわずかに異なる特性を示します。12F3 は線状エピトープを認識することが確認されていますが、11G2 はエピトープの立体構造を認識すると考えられます。
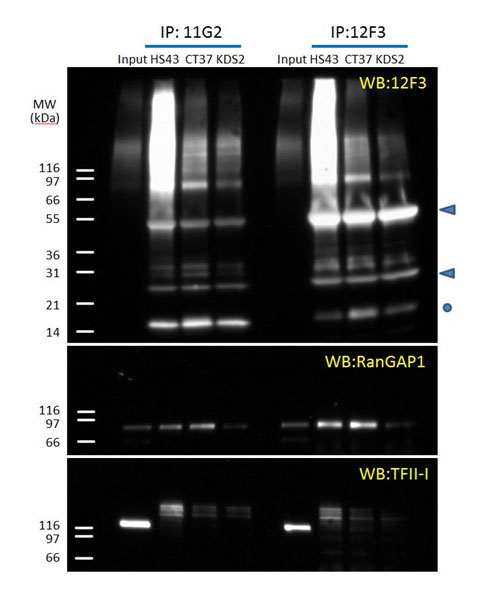
図2 11G2 および 12F3 を用いた SUMO-2/3 の免疫沈降
HS43(43℃ ヒートショック)、CT37(コントロール)、KD S2(SUMO-2 shRNA ノックダウン)から、変性細胞ライセートを調製した15。矢印は抗体の重鎖および軽鎖を、丸印(○)は結合していないフリーのSUMOを示す。
まとめ
PTMにより有糸分裂に関わるタンパク質の機能が微調整されることで、細胞分裂が正常に行われます。PTMの動的な性質を完全に理解するには、基質タンパク質と下流のシグナル伝達カスケードを同定する必要があります。有糸分裂(およびその他の細胞プロセス)におけるPTMを介した調節機構は、その多くがまだ発見されていません。Cytoskeleton社では、SUMO-2/3 によるSUMO化を含む、様々なPTMに特異的な抗体を開発しました。これらの抗体は、新しいPTMターゲットの検出や研究、および、有糸分裂やその他の細胞プロセスにおける調節機構の解析にご利用いただけます。
参考文献
- Dasso M. 2008. Emerging roles of the SUMO pathway in mitosis. Cell Div. 3, 5.
- Hay R.T. 2005. SUMO: a history of modification. Mol. Cell. 18, 1-12.
- Wang Y. et al. 2009. SUMOylation and deSUMOylation at a glance. J. Cell Sci. 122, 4249-4252.
- Uzunova K. et al. 2007. Ubiquitin-dependent proteolytic control of SUMO conjugates. J. Biol. Chem. 282, 34167-34175.
- Prudden J. et al. 2007. SUMO-targeted ubiquitin ligases in genome stability. EMBO J. 26, 4089-4101.
- Ayaydin F. et al. 2004. Distinct in vivo dynamics of vertebrate SUMO paralogues. Mol. Biol. Cell. 15, 5208-5218.
- Ban R. et al. 2011. Mitotic kinase Aurora-B is regulated by SUMO-2/3 conjugation/deconjugation during mitosis.Genes Cells. 16, 652-669.
- Klein U.R. et al. 2009. RanBP2 and SENP3 function in a mitotic SUMO2/3 conjugation-deconjugation cycle on Borealin. Mol. Biol. Cell. 20, 410-418.
- Azuma Y. et al. 2003. SUMO-2/3 regulates topoisomerase II in mitosis. J. Cell Biol. 163, 477-487.
- Zhang X.D. et al. 2008. SUMO-2/3 modification and binding regulate the association of CENP-E with kinetochores and progression through mitosis. Mol. Cell. 29, 729-41.
- Becker J. et al. 2013. Detecting endogenous SUMO targets in mammalian cells and tissues. Nat. Struct. Mol. Biol.20, 525-31.
- Da Silva-Ferrada E. et al. 2013. Analysis of SUMOylated proteins using SUMO-traps. Sci. Rep. 3, 1690.
- Rosas-Acosta et al. 2005. A universal strategy for proteomic studies of SUMO and other ubiquitin-like modifiers.Mol. Cell Proteomics. 4, 56-72.
- Joseph J. et al. 2002. SUMO-1 targets RanGAP1 to kinetochores and mitotic spindles. J. Cell Biol. 156, 595-602.
- Barysch S.V. et al. 2014. Identification and analysis of endogenous SUMO1 and SUMO2/3 targets in mammalian cells and tissues using monoclonal antibodies. Nat. Protoc. 9, 896-909.
アセチルリジン マウスモノクローナル抗体
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥38,000 |
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
CYT社 AAC01L 2*100 を参照 |
ホスホチロシン(リン酸化チロシン) マウスモノクローナル抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Phosphotyrosine (Trial Size), (Mouse) , 27B10.4 |
CYT | APY03-S | 1*25 UL |
¥18,000 |
Anti Phosphotyrosine, (Mouse) , 27B10.4 |
CYT | APY03 | 2*100 UL |
CYT社 APY03 3*100 を参照 |
SUMO-2/3 マウスモノクローナル抗体(クローン 12F3)
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti SUMO 2/3 (Trial Size), (Mouse) , 12F3 |
CYT | ASM23-S | 25 UL [1 x 25 μl] |
¥38,000 |
Anti SUMO-2/3, (Mouse) , 12F3 |
CYT | ASM23 | 200 UL [2 x 100 μl] |
CYT社 ASM23L 2*100 を参照 |
SUMO-2/3 マウスモノクローナル抗体(クローン 11G2)
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti SUMO-2/3 (Trial Size), (Mouse) , 11G2 |
CYT | ASM24-S | 1*150 UL |
¥49,000 |
Anti SUMO-2/3, (Mouse) , 11G2 |
CYT | ASM24 | 2*200 UL |
CYT社 ASM24L 2*200 を参照 |
ユビキチン マウスモノクローナル抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥38,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
CYT社 AUB01L 2*100 を参照 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













